
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
IV. Индифферентные (безразличные)
|
|
|
|
Химические свойства амфотерных оксидов
Амфотерные оксиды могут реагировать:
 1. с кислотами:
1. с кислотами:
ZnO + 2HCl → ZnCl2 + H2O
2. со щелочами: Доказательство
+ Н2О амфотерности
а) ZnO + 2NaOH → Na2[Zn(OH)4] ZnO
тетрогидрооксо-
цинкат натрия
б) ZnO + 2NaOH → Na2ZnO2 + H2O
твёрдый
Переходным металлам соответствуют амфотерные оксиды и гидроксиды.
Пример:

 Zn ZnO Zn(OH) 2 H2ZnO2
Zn ZnO Zn(OH) 2 H2ZnO2
переходный амфотерный амфотерный цинковая
металл оксид гидроксид кислота
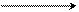
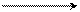
 Al Al2O3 Al(OH) 3 H3AlO3
Al Al2O3 Al(OH) 3 H3AlO3
переходный амфотерный амфотерный ортоалюминиевая
металл оксид гидроксид кислота
Это оксиды, которые не взаимодействуют ни с основаниями, ни с кислотами, не проявляют ни кислотных, ни основных свойств (N2O, NO).
Способы получения оксидов:
1. Непосредственное соединение элементов с кислородом:
2Mg + O2 → 2MgO
2. Косвенным путем: разложением оснований, кислот, солей.
t
Cu(OH) 2 → CuO + H2O
H2CO3 D CO2↑ + H2O
t
CaCO3↓ → CaO + CO2↑
3. Горение сложных веществ:
t
СН4 + 2О2 → СО2↑ + 2Н2О
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 529; Нарушение авторских прав?; Мы поможем в написании вашей работы!