
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ароматические углеводороды (арены)
I. Общая характеристика аренов.
Ароматическими называют соединения, в молекулах которых имеется циклическая группа атомов с особым характером связи – ядро бензола.
Простейшим представителем аренов является бензол, его эмпирическая формула С6Н6. Общая формула моноциклических аренов СnH2n-6 показывает, что они являются ненасыщенными соединениями.
В 1865 году немецкий химик Кекуле предложил циклическую формулу бензола с сопряженными связями (чередуются простые и двойные связи):



 СН
СН

 НС СН
НС СН

 или
или
НС СН
СН
циклогексантриен – 1,3,5
Такая формула не объясняла многие свойства бензола:
1) Для бензола характерны реакции замещения, а не реакции присоединения.
Реакеакции присоединения возможны, но они протекают труднее, чем у алкенов.
2) Бензол не вступает в реакции, являющиеся качественными на непредельные углеводороды (с бромной водой и раствором КМnO4.
Электронографические исследования, проведенные позже, показали, что все связи между атомами углерода в молекуле бензола имеют одинаковую длину 0,140 нм (среднее значение между длиной простой связи С – С 0,154 нм и двойной связи С ═ С 0,134 нм). Угол между связями у каждого атома углерода равен 120º. Молекула представляет собой правильный плоский шестиугольник.
Современная теория для объяснения строения молекулы С6Н6 использует представление о гибридизации орбиталей атома углерода.
Атомы углерода в бензоле находятся в состоянии
sp2 – гибридизации. Каждый атом «С» образует три σ-
 связи (две с атомами углерода и одну с атомом водоро- СН
связи (две с атомами углерода и одну с атомом водоро- СН
да). Все σ – связи находятся в одной плоскости:
 НС СН
НС СН
НС СН
СН
Каждый атом углерода имеет один р-электрон, который не участвует в гибридизации. Негибридизированные р-орбитали атомов углерода находятся в плоскости, перпендикулярной плоскости σ-связей. Каждое р-облако перекрывается с двумя соседними р-облаками и в результате образуется единая сопряженная π-система.
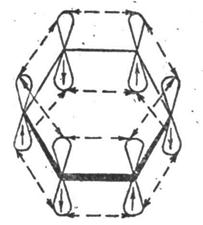 Сочетание шести σ-связей с единой π-
Сочетание шести σ-связей с единой π-
-системой называется ароматической связью.
Цикл из шести атомов углерода, свя-
занных ароматической связью, называется
бензольным кольцом, или бензольным яд-
ром.
II. Номенклатура аренов.
Гомологи ароматических углеводородов надо рассматривать как производные бензола, в которых один или несколько атомов водорода замещены различными углеводородными радикалами.
С6Н5─ СН3 С6Н5─ С2Н5 С6Н4(СН3)2
метилбензол этилбензол диметилбензол
(толуол) (ксилол)
Радикал бензола имеет формулу —С6Н5 и называется фенил.
III. Изомерия аренов.
Для аренов характерна изомерия двух видов:
1) изомерия числа и строения заместителей;
2) изомерия положения заместителей (орто-, мета-, пара-изомерия).
Так как в бензоле все атомы углерода равноценны, то у первого гомолога метилбензола изомеры отсутствуют. У второго изомера диметилбензола имеются три изомера:





 1 CH3 1 CH3 1 CH3
1 CH3 1 CH3 1 CH3



 6 2 CH3 6 2 6 2
6 2 CH3 6 2 6 2
5 3 5 3—— CH3 5 3
4 4 4
 CH3
CH3
1,2 – диметилбензол 1,3 – диметилбензол 1,4 – диметилбензол
орто-диметилбензол мета-диметилбензол пара-диметилбензол
орто- ксилол мета-ксилол пара-ксилол
Орто-изомеры – это изомеры, в которых заместители находятся у соседних атомов угле-рода.
Мета-изомеры – это изомеры, в которых заместители разделены одним атомом углерода.
Пара-изомеры – это изомеры, в которых заместители разделены двумя атомами углерода
бензольного кольца.

 С8Н10
С8Н10
 |  |











 а)С2Н5 б) СН3 в) СН3 г) СН3
а)С2Н5 б) СН3 в) СН3 г) СН3
─ СН3 ─ СН3


 СН3
СН3


изомерия положения заместителей


 (орто-, мета-, пара-изомерия)
(орто-, мета-, пара-изомерия)
изомерия числа и строения заместителей
IV. Физические свойства аренов.
Все арены имеют плотность меньше 1, то есть все они легче воды и в воде не растворимы.
Cпособы получения аренов.
Арены получают в промышленности:
1. При переработке нефти и каменного угля.
2.  Из предельных углеводородов:
Из предельных углеводородов:
 t, k, P
t, k, P
СН3 ─ СН2 ─ СН2 ─ СН2 ─ СН2 ─ СН3 ————————→ + + 4Н2↑
гексан
бензол
3. Из алициклических углеводородов:
 СН2
СН2

 СН2 СН2
СН2 СН2
t=300ºC, K
СН2 СН2 ————————————→ + 3Н2↑
СН2
циклогексан бензол
4. В лаборатории можно получить бензол сплавлением бензойной кислоты со щелочами:



О
//

 ─ С
─ С

 t
t
 ОNa + NaO H ———→ + Na2CO3
ОNa + NaO H ———→ + Na2CO3
бензоат бензол
натрия
VI. Химические свойства бензола.
|
|
Дата добавления: 2013-12-12; Просмотров: 859; Нарушение авторских прав?; Мы поможем в написании вашей работы!