
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Первый закон термодинамики. Основные понятия, используемые в химической термодинамике
|
|
|
|
Основные понятия, используемые в химической термодинамике
ВВЕДЕНИЕ
Оглавление
Конспект лекций
Кафедра физической и аналитической химии
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
ГОувпо «Воронежская Государственная
Технологическая Академия»
Конспект лекций
для студентов, обучающихся по направлениям
260200 – Производство продуктов питания из растительного сырья;
260300 – Технология сырья и продуктов животного происхождения;
260500 – Технология продовольственных продуктов специального
назначения и общественного питания
дневной и заочной форм обучения
Воронеж 2010
| Введение……………………………………………………………………………. | ||
| Раздел I. Основы химической термодинамики…………………… | ||
| 1.1 Основные понятия, используемые в химической термодинамике……….. | ||
| 1.2 Первый закон термодинамики и его применение к различным процессам……………………………………………………………………….... | ||
| 1.3 Термохимия | ||
| 1.3.1 Закон Гесса и следствия из него. Расчет тепловых эффектов химических реакций в стандартных условиях…………………….... | ||
| 1.3.2 Понятие о теплоемкости веществ…………………………………… | ||
| 1.3.3 Влияние температуры на тепловой эффектхимической реакции. Уравнение Кирхгофа…………………………………………………. | ||
| 1.4 Второй закон термодинамики. Энтропия…………………………………. | ||
| 1.4.1 Процессы самопроизвольные и несамопроизвольные, обратимые и необратимые…………………………………………................ | ||
| 1.4.2 Формулировки и математическое выражение II закона термодинамики……………………………………………………………….. | ||
| 1.4.3 Изменение энтропии – критерий направления самопроизвольных процессов в изолированных системах | ||
| 1.4.4 Статистическая интерпретация энтропии…………………………….. | ||
| 1.4.5 Расчет изменения энтропии при протекании некоторых процессов……………………………………………………………………… | ||
| 1.4.6 Абсолютные значения энтропии твердых, жидких и газообразных тел………………………………………………………….... | ||
| 1.5 Термодинамические потенциалы и направление самопроизвольных процессов………………………………………………………………………… | ||
| Раздел II. Растворы и гетерогенные равновесия………………….. | ||
| 2.1 Основные понятия и определения…...……………………………………... | ||
| 2.2 Химический потенциал……………………………………………………… | ||
| 2.3 Условие термодинамического равновесия в растворе…………………….. | ||
| 2.4 Условие равновесия в гетерогенной системе……………………………… | ||
| 2.5 Правило фаз Гиббса…………………………………………………………. | ||
| 2.6 Равновесие в однокомпонентной двухфазной системе. Уравнение Клаузиуса-Клапейрона………………………………………….. | ||
| 2.7 Применение правила фаз Гиббса к анализу диаграммы состояния однокомпонентной системы………………………………………………… | ||
| 2.8 Равновесие в гетерогенных системах, состоящихиз двух и более компонентов………………………………………………………………….. | ||
| 2.8.1 Равновесие жидкость-пар……………...………………………………. | ||
| 2.8.2 Коллигативные свойства растворов………………………………....... | ||
| Понижение давления пара над раствором по сравнению с чистым растворителем……………………………………………….. | ||
| Повышение температуры кипения растворов………………………… | ||
| Понижение температуры замерзания растворов……………………... | ||
| Осмос. Осмотическое давление……………………………………….. | ||
| 2.8.3 Равновесие жидкость-жидкость. Распределение вещества между двумя несмешивающимися жидкостями……………………… | ||
| Раздел III. химическое равновесие……………………………………… | ||
| 3.1 Уравнение изотермы химической реакции………………………………... | ||
| 3.2 Влияние внешних условий на протекание химической реакции………… | ||
| Раздел IV. Электрохимия…………………………………………………….. | ||
| 4.1 Равновесие в растворах слабых электролитов…………………………….. | ||
| 4.2 Термодинамика растворов сильных электролитов………………………... | ||
| 4.3 Электрическая проводимость растворов электролитов…………………... | ||
| 4.4 Электродвижущие силы и электродные потенциалы……………………... | ||
| Гальванические элементы как источники электрического тока…………. | ||
| Механизм возникновения электродных потенциалов и их расчет……….. | ||
| Термодинамика гальванического элемента………………………………... | ||
| Основные типы электродов и расчет их потенциала……………………… | ||
| Раздел V. химическая кинетика и катализ………………………….. | ||
| 5.1 Основной закон химической кинетики. Порядок и молекулярность Реакции…………………………………………………………………………… | ||
| 5.2 Основы формальной кинетики кинетика необратимых реакций………… | ||
| 5.3 Методы определения порядка реакции……………………………………. | ||
| 5.4 Влияние температуры на скорость реакции……………………………….. | ||
| 5.5 Основные понятия катализа………………………………………………… |
|
|
|
|
|
|
Химические реакции связаны с разнообразными физическими явлениями: выделением и поглощением теплоты, изменением объема, испусканием света, электрическими явлениями и т.д. В химических реакциях всегда осуществляется тесная связь физических и химических явлений, изучение этой взаимосвязи – основная задача физической химии.
Физическая химия – это наука о взаимосвязи физических и химических явлений. Физическая химия, опираясь на фундаментальные законы физики и используя результаты физико-химических экспериментов, исследует свойства вещества и химические реакции в совокупности с сопутствующими им физическими явлениями. Она также изучает влияние внешних воздействий на свойства веществ, на химические и фазовые равновесия, скорость протекания химических реакций.
|
|
|
Главное внимание в физической химии уделяется установлению закономерностей протекания химических процессов: возможности их осуществления, направления, механизма, скорости и конечных результатов при различных условиях. Установление таких закономерностей в конечном итоге позволяет прогнозировать ход химического процесса и управлять им, т.е. обеспечивать наиболее полное и быстрое его проведение.
Рассмотрим пример. Синтез аммиака ведется при высоком давлении в присутствии катализатора согласно реакции:
 N2 + 3H2 2NH3
N2 + 3H2 2NH3
Если данную реакцию проводить при давлении р = 850 атм, то содержание NH3 в реакционной смеси составляет 30 %. Если же давление повысить до 1700 атм, то выход аммиака повышается до 50 %. Таким образом, при изменении лишь одного физического параметра выход конечного продукта повышается почти в два раза.
Температура, как известно, оказывает существенное влияние на скорость реакции (при повышении температуры на каждые 10 ºС скорость реакции увеличивается в 2 – 4 раза). Однако для некоторых процессов повышение температуры наряду с увеличением скорости может привести к уменьшению выхода продуктов реакции.
Таким образом, изменяя различные физические параметры, можно управлять процессом и подбирать оптимальные условия его проведения.
Возникновение физической химии относится к середине XVIII в. и связано с именем великого русского ученого М.В. Ломоносова. В 1752 г. он написал «Введение в истинную физическую химию», в котором дал близкое к современному определение ее предметной области: «Физическая химия есть наука, объясняющая на основании положений и опытов физики, то, что происходит в сложных телах при химических операциях».
Физическая химия является теоретической основой современных технологий.
Раздел I. Основы химической термодинамики
|
|
|
Термодинамика – Наука о взаимном превращении одних видов энергии в другие.
Различают общую, техническую и химическую термодинамику.
Общая термодинамика рассматривает теоретические основы всех направлений термодинамики.
В технической термодинамике рассматриваются взаимные превращения теплоты и работы применительно, главным образом, к конструированию и эксплуатации тепловых двигателей.
Химическая термодинамика – раздел физической химии, в котором термодинамические методы применяются для анализа химических и физико-химических процессов – химических реакций, фазовых переходов, явлений в растворах и т.п.
Объектом изучения термодинамики является термодинамическая система.
Термодинамическая система (или просто система) – это тело или совокупность тел, выделяемых в пространстве с помощью реально существующей или воображаемой границы. Иными словами, система – это та часть материального мира, которая является предметом нашего наблюдения или исследования. Системой может быть, например, колба с реакционной смесью, человек, теплообменник на предприятии.
Остальная часть материального мира, т.е. за пределами условно выделенной из него системы, – окружающая среда.
Термодинамическая система обязательно должна содержать большое число частиц (молекул, атомов). Системы с малым числом частиц термодинамика не рассматривает.
Взаимодействие системы с окружающей средой состоит из обмена энергией и веществом. Различают открытые, закрытые и изолированные системы.
 |
Состояние любой термодинамической системы может быть охарактеризовано количественно с помощью термодинамических параметров состояния. Различают два типа параметров состояния.
Экстенсивные параметры пропорциональны количеству вещества системы. Например, объем, масса, площадь поверхности, заряд.
Интенсивные параметры не зависят от количества вещества (температура, давление, поверхностное натяжение). Интенсивными параметрами являются также удельные (т.е. отнесенные к чему-либо) значения экстенсивных параметров, например, концентрации веществ, мольные объемы.
Уравнения, связывающие параметры состояния термодинамической системы, – уравнения состояния данной системы.
Например, уравнением состояния идеального газа является уравнение Менделеева-Клапейрона
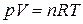 . (1.1)
. (1.1)
В качестве параметров состояния идеального газа могут быть выбраны любые два параметра из трех – p, V, T. Этого достаточно, поскольку третий параметр может быть рассчитан по уравнению (1.1).
Процесс – это любое изменение в системе, приводящее к изменению, по крайней, хотя бы одного параметра состояния.
Отметим некоторые частные виды процессов:
1) изотермический (T = const);
2) изобарный (р = const);
3) изохорный (V = const);
4) адиабатический (нет теплообмена с окружающей средой);
5) изобарно-изотермический (р, T = const);
6) изохорно-изотермический (V, T = const).
Если в результате процесса система возвращается в исходное состояние, такой процесс называется круговым (или циклом). Циклические процессы часто совершаются в природе и технике, например, при работе двигателя внутреннего сгорания.
Материя не может существовать без движения, а мерой движения является энергия.
Энергия (философская категория) – это мера способности системы совершать работу. Энергия может существовать в разнообразных формах, например, химическая, электрическая, механическая, ядерная, солнечная энергия.
Механическая энергия, в свою очередь, подразделяется на кинетическую энергию и потенциальную энергию.
Кинетическая энергия – это энергия, связанная с движением тела.
Потенциальная энергия – это энергия, запасенная телом.
Химическая система может состоять из атомов, молекул и ионов либо из любой их комбинации. Все эти частицы обладают кинетической и потенциальной энергией. Сумма кинетической и потенциальной энергий всех частиц в системе называется внутренней энергией системы. Внутренняя энергия обозначается буквой U.
Кинетическая энергия движения самой системы и потенциальная энергия положения ее в пространстве во внутреннюю энергию не входят.
Абсолютное значение внутренней энергии определить невозможно, но легко найти изменение ее Δ U при переходе системы из исходного состояния 1 в конечное 2:
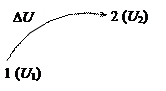 Δ U = U 2 – U 1.
Δ U = U 2 – U 1.
Величина Δ U считается положительной, если в рассматриваемом процессе внутренняя энергия системы возрастает.
Работа А и теплота Q – две возможные формы передачи энергии от одной системы к другой. При этом теплота связана с беспорядочным (хаотическим) перемещением микрочастиц: энергия передается путем хаотических столкновений молекул соприкасающихся тел, т.е. путем теплопроводности. Работа – форма передачи энергии путем упорядоченного движения частиц. Например, расширение газа, находящегося под давлением.
Теплота и работа, в отличие от внутренней энергии, не являются свойствами системы: они возникают только тогда, когда возникает процесс, и характеризуют только процесс. Теплота и работа в общем случае являются функцией процесса.
Внутренняя энергия – функция состояния. Термодинамические функции состояния – это величины, которые зависят от параметров состояния.
Термодинамические функции состояния имеют ряд важных свойств.
1) Изменение функции состояния определяется только исходным и конечным состоянием системы и не зависит от пути перехода этой системы из исходного в конечное состояние. С математической точки зрения это означает, что любое бесконечно малое изменение функции состояния системы является полным дифференциалом:
 .
.
В круговом процессе конечное состояние совпадает с начальным, поэтому любая функция состояния принимает первоначальное значение, а ее изменение равно нулю:
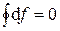 .
.
2) Свойство аддитивности: величина термодинамической функции для всей системы складывается из величин этой функции для определенных частей системы.
Единица измерения Q, U, A в системе СИ – Дж (Н×м).
|
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 1105; Нарушение авторских прав?; Мы поможем в написании вашей работы!