
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гальванические элементы как источники электрического тока
|
|
|
|
Электродвижущие силы и электродные потенциалы
Взаимное превращение электрической и химической энергии происходит в электрохимических системах, состоящих из:
– проводников II рода (веществ, обладающих ионной проводимостью, т.е. электролитов);
– проводников I рода (веществ, обладающих электронной проводимостью, т.е. металлов), находящихся в контакте с электролитом.
Такие системы называется электродами.
При переходе заряженных частиц (ионы, электроны) через границу раздела фаз, например, раствор электролита – металл возникает электрохимическая реакция. В результате этого металл и раствор приобретают электрический заряд, и на границе раздела фаз образуется двойной электрический слой, которому соответствует скачок потенциала.
Электродные процессы представляют собой окислительно-восстановительные реакции:
Ох + ze– Û Red.
Различают обратимые и необратимые электроды. При перемене направления электрического тока на обратимых электродах протекают реакции, противоположные по направлению, а на необратимых – не обратные друг другу. Из обратимых электродов могут быть составлены обратимые электрохимические цепи (гальванические элементы).
Электрической характеристикой электрода является потенциал, а электрохимической цепи – электродвижущая сила (ЭДС), равная разности скачков потенциала, возникающих на границе раздела фаз электродов, входящих в состав цепи.
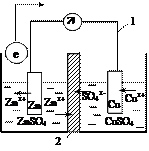 Устройство, в котором химическая энергия преобразуется в электрическую, называется гальваническим элементом.
Устройство, в котором химическая энергия преобразуется в электрическую, называется гальваническим элементом.
Примером гальванического элемента служит элемент Даниэля-Якоби, который состоит из цинкового и медного электродов, находящихся в замкнутой электрической цепи. Цинковый электрод состоит из цинковой пластины, опущенной в раствор ZnSO4. Медный электрод – медная пластина, погруженная в раствор CuSO4. Растворы отделены друг от друга пористой перегородкой, через которую из одного раствора в другой проникают ионы (внутренняя цепь).
|
|
|
При работе гальванического элемента на цинковом электроде происходит реакция окисления (цинковая пластина растворяется):
Zn – 2e–® Zn2+.
Электроны по внешней цепи (1) перемещаются от цинкового электрода к медному. Избыток электронов придает пластине отрицательный заряд. На медном электроде идет реакция восстановления ионов меди (медь осаждается на пластине). Медная пластина заряжается положительно и масса ее увеличивается. По внутренней цепи (2) перемещаются ионы. Процессы, протекающие в гальваническом элементе, описываются суммарной реакцией:
Zn + Cu2+ D Zn2+ + Cu.
Если во внешнюю цепь включить гальванометр, то он покажет величину тока, который протекает в цепи. Ток в гальваническом элементе протекает в результате возникновения разности потенциалов (ЭДС) между цинковым и медным электродами. Величина ЭДС определяется скачками потенциалов на границе раздела металл – раствор его соли, а также диффузионным потенциалом, возникающим на границе контакта двух растворов.
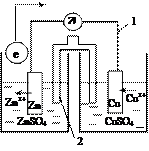 Диффузионный потенциал обусловлен различной подвижностью ионов, перемещающихся через перегородку. Наличие диффузионного потенциала снижает точность измерений, и его стараются устранить. Для этого на границе двух растворов помещают солевой мостик, заполненный концентрированным раствором KCl или NH4NO3. В этом случае диффузионный потенциал на границе между солевым мостиком и раствором определяется диффузией ионов К+, Cl- или NH4+, NO3–. Уменьшение диффузионного потенциала объясняется близкими подвижностями и числами переноса ионов указанных солей.
Диффузионный потенциал обусловлен различной подвижностью ионов, перемещающихся через перегородку. Наличие диффузионного потенциала снижает точность измерений, и его стараются устранить. Для этого на границе двух растворов помещают солевой мостик, заполненный концентрированным раствором KCl или NH4NO3. В этом случае диффузионный потенциал на границе между солевым мостиком и раствором определяется диффузией ионов К+, Cl- или NH4+, NO3–. Уменьшение диффузионного потенциала объясняется близкими подвижностями и числами переноса ионов указанных солей.
Устройство гальванического элемента изображают условно:
|
|
|
(–) Zn/ZnSO4//CuSO4/Cu (+).
Ме раствор раствор Ме
Принято слева записывать электрод, на котором идет реакция окисления (отрицательный электрод), а справа электрод, на котором идет реакция восстановления (положительный электрод). Одна вертикальная линия указывает, на то, что между фазами имеется контакт, а две линии означают, что прямого контакта между фазами нет, т.е. растворы соединены электролитическим мостиком.
|
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 540; Нарушение авторских прав?; Мы поможем в написании вашей работы!