
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Радіоактивні мітки
|
|
|
|
Методи аналізу: імуноферментний (ІФА), імунолюмінесцентний, імунорадіологічний
Висока специфічність антитіл відносно антигену перетворює їх у потужний інструмент для ідентифікації різних речовин, будь то макромолекули, клітинні фрагменти або цілі клітини.
Початок широкому використанню антитіл у діагностичних цілях поклав в 1955 році американський імунолог А. Кунс. Він приєднав до антитіл барвник, що світиться. Флуоресцентні антитіла зробили видимими місця розташування молекул, які його цікавили, у клітині. Цей метод отримав назву імунофлуоресцентного. Чутливість методу можна підвищити декількома шляхами.
У першому випадку імунна відповідь підсилюється за рахунок застосування антитіл декількох порядків:
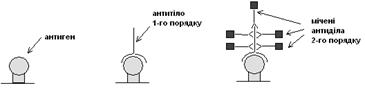
Антиген іммобілізується на підкладці, до нього додаються антитіла 1-го порядку, що зв’язуються безпосередньо з антигеном. У досліджуваний зразок додаються антитіла 2-го порядку, що зв’язуються з антигенними детермінантами антитіл 1-го порядку. Антитіла 2-го порядку мають флуоресцентну (або іншу) мітку. Оскільки ділянок зв’язування може бути декілька, то реакція проявляється більш чітко.
Інша система посилення сигналу заснована на високій спорідненості біотину (низькомолекулярного розчинного вітаміну) до стрептовідину (бактеріального білка). В даному випадку можливі два варіанти:
А. Якщо можливо ковалентно зв’язати біотин безпосередньо з антитілами, то стрептовідин мітять маркером і використовують аналогічно антитілам другого порядку:
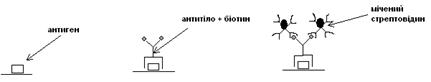
Б. Система “біотин-антитіло + стрептовідин + мічений біотин”:

У цьому випадку утвориться ціла сітка з молекул стрептовідину, зв’язаного з міченим біотином. Отже, відбувається багаторазове посилення сигналу.
|
|
|
Застосування антитіл другого й третього порядків дозволяє також спрощувати процедуру визначення мікроорганізмів у мазку. При цьому не обов’язково мати мічені антитіла проти всіх бактерій. Досить мати звичайні антитіла кролика або миші проти мікроорганізму, що цікавить, і мічені МКА проти цих імуноглобулінів. Якщо мікроорганізм у мазку присутній, то до нього “приклеються” специфічні антитіла, а до них уже – мічені. У результаті мазок буде світиться при люмінесцентній мікроскопії. Фотометричні або флуоресцентні методи можуть бути використані не у всіх випадках, наприклад, якщо вимірювання проводять в дуже мутному середовищі.
Крім барвника в якості мітки можна використати фермент (імуноферментний аналіз) або радіоактивний ізотоп (імунорадіологічний). Від чутливості детекції маркера залежить чутливість методу аналізу.
Вибір маркера й способу його «прив’язки» до антигену є одним з важливих етапів у проведенні аналізу. Спочатку широко застосовувалися радіоізотопні мітки (радіоімуний аналіз – РІА), запропоновані американськими дослідниками (С. А. Берсон, Р. С. Ялоу, 1959). Однак в останні роки усе більше використовуються як маркери ферменти. Це обумовлено рядом принципових труднощів, пов’язаних із застосуванням ізотопниx маркерів. Так, ізотоп 125I має час напіврозпаду 60 діб, чим обмежується строк його використання. Ізотоп 3Н має тривалий час життя (12,5 років), однак під дією β-випромінювання відбувається розпад молекул антигену, у результаті чого час життя мічених 3Н-сполук теж обмежений. Крім того, ефективність тритію істотно нижча, ніж 125I. Обмежуючими факторами РІА є складність і висока вартість устаткування, необхідність централізованої системи розподілу імунохімічних наборів, мічених радіоактивними ізотопами, певна небезпека ізотопів для навколишнього середовища. З огляду на труднощі використання радіоізотопних міток, були запропоновані як маркери ферменти.
|
|
|
При імуноферментному аналізі антиген зв’язується з поверхнею лунки полістирольного планшета. У лунку додають антитіла, що несуть фермент у якості мітки, інкубують і відмивають. Далі доливають субстрат, що змінює забарвлення при взаємодії із цим ферментом. Зміну забарвлення можна виміряти за допомогою спектрофотометрії. Таким способом проводиться індикація й кількісна оцінка біоорганічних сполук із чутливістю до 10-12 г/літр.
У наш час відомо більше 2000 різних ферментів, однак тільки деякі знаходять застосування в імуноферментному аналізі. Це пояснюється високими вимогами, що висуваються до властивостей ферментів. Фермент повинен бути високо активний, а продукти його реакції детектуватися з високою чутливістю, він повинен бути стабільним, так щоб його активність зберігалася не менше одного року. Вміст фермента-маркера в певному зразку повинно бути мінімальним. Саме через це для різних об’єктів використовують різні ферменти. У багатьох випадках, коли необхідний якісний результат, оцінка імунохімічної реакції може бути проведена візуально.
Для введення ферментативної мітки розроблено багато різних хімічних, біохімічних й імунологічних способів.
Першим реагентом, використаним для синтезу імуноферментних кон’югатів, був глутаровий альдегід, що реагує з аміногрупами лізинових білкових молекул. За допомогою глутарового альдегіду отримані кон’югати антитіл й антигенів з пероксидазою, лужною фосфатазою, глюкоамілазою. У наш час широко використовуються імунопероксидазні кон’югати й кон’югати з β-галактозидазою.
Ковалентні методи одержання імуноферментних кон’югатів мають досить широке поширення, однак в деяких випадках дія зшиваючого реагенту, негативно позначається на ферментативній й імунологічній активності компонентів гібридної макромолекули. У зв’язку з цим певний інтерес представляють імунологічні методи введення ферментної мітки.
Один з підходів одержав назву методу «гібридних антитіл». Ферментативним гідролізом одержують Fab-фрагменти молекул антитіл проти антигену, який визначають й використовуваний фермент. Потім суміш продуктів гідролізу піддають відновленню меркаптоетанолом; при цьому Fab-фрагменти зворотно дисоціюють на симетричні частини. Після видалення відновлюючого агента молекули знову асоціюють, утворюючи гібридні молекули антитіл, специфічні до антигену, який визначається й ферменту. При додаванні ферменту утворюється комплекс антитіло-фермент. Гібридомна технологія відкриває принципово новий шлях одержання гібридних антитіл, що полягає в тому, що зливаються моноклональні клітини, специфічні проти даного антигену й ферменту-маркера, у результаті чого утворюються гібридоми другого покоління, які синтезують антитіла, з двома специфічностями.
|
|
|
Інший шлях полягає в тому, що одержують антитіла того самого виду тварини (наприклад, кролика) проти антигену, що визначається й ферменту, які з’єднують між собою через антитіла іншого виду тварин (антитіла барана проти кролика). Додавання ферменту до такої потрійної молекули також призводить до утворення комплексу антитіло-фермент. У наш час розробляються підходи одержання гібридних антитіл методами клітинної й генної інженерії, що дозволить істотно спростити спосіб їхнього одержання.
Стабільність імуноферментних кон’югатів при зберіганні – найважливіший параметр, що зумовлює можливість їхнього практичного використання. Методи спрямованої стабілізації кон’югатів поки ще не розроблені. Не існує також кореляції між стабільністю кон’югатів і методом їхнього одержання. Однак висока стабільність гібридних молекул забезпечує їхнє застосування на практиці й значно перевершує стабільність антитіл й антигенів, мічених радіоактивними ізотопами. У ліофілізованому стані ферментні кон’югати зберігають свої властивості до двох років.
Крім ферментів як маркери можуть бути використані субстрати. Зокрема, в імунокофакторному аналізі застосовуються як мітки АТФ і НАД, які можуть бути «пришиті» до молекули антигену через аденіновий залишок таким чином, що зберігається їхня здатність взаємодіяти з ферментом. Аналогічно були використані субстрати пероксидази (люмінол, ізолюмінол), які можуть бути окислені пероксидом водню в реакції хемілюмінесценції, що каталізується пероксидазою.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1089; Нарушение авторских прав?; Мы поможем в написании вашей работы!