
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Жидкости со сверханомальными вязкостями
Лекция № 21
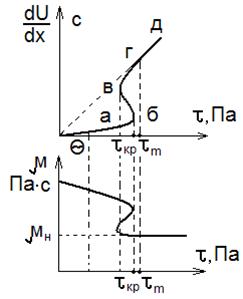
Реологическое уравнение не получено. Наибольший интерес вызывает участок абв. Он соответствует интенсивному разрушению структуры и резкому снижению сопротивления течения. На этом участке напряжение сдвига сначала увеличивается (участок аб), а затем уменьшается (участок бв) с увеличением 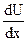 . Здесь наблюдается сильные аномальные вязкости, наибольшее τ соответствует точке б и оно названо критическим напряжением сдвига τКР.
. Здесь наблюдается сильные аномальные вязкости, наибольшее τ соответствует точке б и оно названо критическим напряжением сдвига τКР.
Процесс разработки нужно вести, когда τ > τM.
Образование отложений неорганических солей в процессе добычи нефти. По химическому составу солевые отложения нефтяных месторождений являются смесями неорганических и органических компонентов, включающих продукты коррозии, прочие механические примеси 70%, 90% от состава остатков приходится на соединения сульфата кальция: CaSO4 (сернистый ангидрид); CaSO4∙2H2O (гипс).
Остальные 10%-30% составляют карбонаты кальция и магния (CaСO3, MgSC3), двуокись Si – Si02 – органические вещества, парафины, смолы, асфальтены.
В состав отложений входят и другие соединения: сульфат стронция SrSO4, карбонат Sr – SrCO3, карбонат Ba – BaCO3, MgCO3, хлорид натрия NaCl, сульфат радия RaSO4, встречающиеся механические примеси – продукты коррозии (окиси железа Fe2O3, сульфид железа FeS2). Большинство отложений имеет кристаллическую структуру и механизм отложения солей достаточно изучен.
Изучении отложения солей позволило выделить три характерных вида осадков:
1) плотные микро и мелкокристаллические осадки, представленные сравнительно кристаллами, длиной до 5мм с равномерным включением твердых УВ;
2) плотные осадки с преобладанием крист. гипса, средних размеров 5-12 мм длина, с включением твердых и жидких УВ. Иногда встречаются крупные игольчатые кристаллы, длиной 15-18 мм;
3) плотные крупнокристаллические осадки, крупные игольчатые кристаллы гипса образуют каркас (длина 12-25 мм). Между ними находится более мелкие кристаллы солей и УВ соединения.
Выпадение любого вещества в осадок происходит в том случае, если концентрация этого вещества или ионов в растворе превышает равновесную предельную концентрацию, т.е. когда соблюдается следующее неравенство.
Ci ≥ CiP
Ci – концентрация соединений или ионов, потенциально способных к выпадению осадков.
CiP – равновесная (предельная) концентрация соединения или ионов в растворе. Это неравенство смещается в сторону выпадения осадка, либо за счет увеличения левой части (увеличение фактической концентрации) либо за счет уменьшения правой части (снижение предельной растворимости).
Первое возникает обычно при смещении вод разного состава, химически несовместимых друг с другом.
Второе условие выпадения осадка – перенасыщение вод в результате повышения температуры и давления, выделение газов, когда в исходящем растворе снижается величина предельной или равновесной концентрации.
Причина образования солей.
1) изменение термобарических условий, при этом возможно образование карбоната кальция по следующей схеме:
Ca+2HCO3 = CaCO3↓+H2CO3
В отличие от большинства неорганических солей карбонат кальция лучше растворяется в воде с уменьшением температуры. Если при температуре 100 ˚С его равновесная концентрация составляет 14 мг/л, то при 0 ˚С 85 мг/л.
С уменьшением давления и температуры из раствора выпадает карбонат кальция ибо на направление реакции по вышеприведенной схеме в значительно большей степени, чем температура влияет парциальное давление СО2.
Рассматривая образование солей серной кислоты необходимо отметить следующее: максимальная растворимость гипса наблюдается при t=40 ˚С. При дальнейшем увеличении температуры гипс становится менее растворимым, а растворимость ангидрида уменьшается намного быстрее. Поэтому в скважинах и пластах при температуре больше 40˚С возможно преобладание в отложениях ангидрида.
|
|
Дата добавления: 2013-12-12; Просмотров: 388; Нарушение авторских прав?; Мы поможем в написании вашей работы!