
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства альдегидов и кетонов
|
|
|
|
Электронное строение карбонильной группы. Атом углерода карбонильной группы находится в cостоянии sp2-гибридизации. Его конфигурация плоская: валентные углы между тремя d-связями близки к 120°. p-Связь образуется за счет перекрывания рz АО углерода и рz АО кислорода в плоскости, перпендикулярной плоскости d-связей.
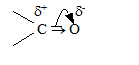
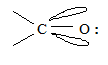
На ру АО кислорода находится неподеленная пара электронов (основной центр). По электронному строению p-связь карбонильной группы имеет аналогию с двойной связью алкенов, однако электронная плотность более компактна и поляризована (смещена в сторону более электроотрицательного атома кислорода).
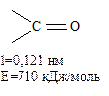
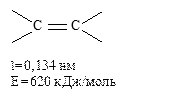
В силу значительной полярности связи C = О она склонна к гетеролитическому разрыву. Атом углерода имеет электрофильный характер и восприимчив к атаке нуклеофильных реагентов:
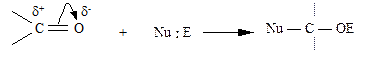
Таким образом, для карбонильной группы будут характерны реакции нуклеофильного присоединения АN (в отличие от АE для двойных связей). Карбонильная группа имеет высокий отрицательный индуктивный эффект (-Iс=о).
Из сказанного следует, что реакционную способность карбонильной группы традиционно объясняют с использованием представлений об ее поляризуемости. Однако, если поляризуемость карбонильной группы является главной причиной ее активности, то кетоны должны быть более активными по отношению к нуклеофильным реагентам. Однако опыт показывает обратное: альдегиды более активные соединения. Такое различие не объяснятся также энергиями ВЗМО альдегидов и кетонов. ВЗМО в них является no-МО. В случае ароматических - π бенз.-МО. Дело в том, что карбонильная группа легко вступает в реакции нуклеофильного присоединения. А у кетонов энергия ионизации намного меньше, чем у альдегидов, т.е. первые являются более хорошими донорами электронов и должны хуже реагировать с нуклеофилами. Различие нужно искать в НСМО. По энергии НСМО у кетонов находится значительно выше, чем у альдегидов, т.е. НСМО у кетонов значительно менее доступна по отношению к нуклеофилам. Отсюда и меньшая реакционная способность кетонов в реакциях нуклеофильного присоединения.
|
|
|
Таблица 2
Потенциалы ионизации и электронное сродство некоторых карбонильных соединений.
| Орбитали | Потенциталы ионизации(ПИ) и сродство к электрону(А), эВ | |||
| НС(О)Н | СН3С(О)Н | (СН3)2С=О | С6Н5С(О)Н | |
| НСМО π*С=О | - 0.86 | - 1.19 | - 1.51 | - 0.76 π*бензола |
| ВЗМО nоу | 10.8 | 10.26 | 9.76 | 9.80 π бензола 10.0 no |
| πС=О | 14.5 | 13.24 | 12.59 | 14.09 |
Реакционные центры. Исходя из электронного строения и электронных эффектов, в молекуле альдегида (кетона) можно выделить следующие реакционные центры, которые определяют их реакционную способность: электрофильный, основной и СН-кислотный центры.
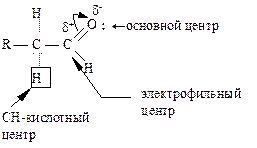
Электронная плотность от атомов водорода смещена на α-углеродный атом, этим вызвана легкость его замещения. Подвижностью атома водорода в α-положении объясняется и явление кето-енольной таутомерии альдегидов и кетонов
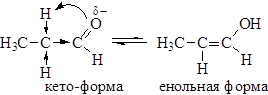
Кето-енольная таутомерия обуславливает некоторые реакции альдегидов и кетонов, которые будут рассмотрены ниже.
Различие в реакционной способности альдегидов и кетонов. С одной стороны, с точки зрения представлений о поляризуемости карбонильной группы можно отметить, что у кетонов, имеющих два радикала, обладающих +I эффектом, снижена электрофильность атома углерода, а с другой стороны у них НСМО лежит выше, чем у альтдегидов. Этим обстоятельством можно объяснить снижение реакционной способности кетонов по отношению к нулкофилам. При наличии объемных заместителей у кетонов создаются также пространственные затруднения для атаки нуклеофила, и протекание АN реакций становится невозможным:
|
|
|

У альдегидов при атоме углерода карбонильной группы содержится атом Н. Вследствие электрофильности атома углерода связь С — Н поляризуется, водород становится подвижным и легко окисляемым.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1296; Нарушение авторских прав?; Мы поможем в написании вашей работы!