
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость химической реакции и химическое равновесие
|
|
|
|
Каждая химическая реакция характеризуется кинетическим (скорость) и термодинамическим (равновесие) аспектами.
Скоростью химической реакции называется изменение концентрации веществ в ходе реакции в единицу времени:
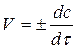
Кинетическое уравнение, связывающее скорость данной реакции с концентрацией реагирующих веществ, имеет вид:
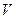 = k [A][B],
= k [A][B],
что представляет собой выражение закона действующих масс (ЗДМ), в соответствии с которым скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных соответствующим стехиометрическим коэффициентам. Постоянный множитель k в кинетическом уравнении называется константой скорости реакции и показывает скорость реакции при концентрации каждого реагента равной 1 моль/л. Константа скорости химической реакции зависит от природы реагирующих веществ и температуры в соответствие с уравнением Аррениуса:
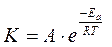
где: А – предэкспоненциальный множитель, зависящий от числа соударений реагирующих частиц между собой;
Еа – энергия активации, Дж/моль;
R – универсальная газовая постоянная, 8,31 Дж/Kмоль;
Т – абсолютная температура, K
Значения константы скорости реакции меняется в широких пределах (от 10-7до 1011 единиц), что указывает на значительное различие в скорости разных реакций. В аналитической химии применяют в основном быстрые реакции. Для ускорения медленных реакций в соответствии с уравнением Аррениуса используют повышение температуры (нагревание) и катализаторы (уменьшение энергии активации).
При протекании любой химической реакции наряду с прямой реакцией имеет место и обратная (обратимость реакции), причем при определенных условиях наступает такой момент когда скорости прямой и обратной реакций становятся одинаковыми. Этот момент называется химическим равновесием, а концентрации веществ, участвующих в этом равновесии, называют равновесными. Химическое равновесие является подвижным (динамическое равновесие) и на него можно влиять как со стороны исходных веществ, так и со стороны продуктов реакции в соответствии с принципом Ле-Шателье. Для обратимой реакции A + B ↔ C + D в соответствии с ЗДМ скорости прямой и обратной реакции могут быть записаны следующим образом:
|
|
|
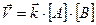

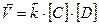
Тогда, в момент равновесия:
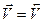 и
и 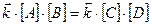
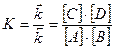
Величина называется концентрационной константой химического равновесия или концентрационной константой равновесия. Концентрационная константа равновесия для данной конкретной реакции зависит от температуры, природы реагирующих веществ и растворителя, ионной силы раствора. В справочной литературе значения концентрационных констант равновесия реакций приводятся с обязательным указанием температуры и ионной силы раствора, природы растворителя.
В более общем случае, когда стехиометрические коэффициенты отличаются от единицы, т.е. для реакции
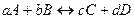
условие наступления химического равновесия определяется уравнением
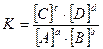
Это уравнение представляет собой математическое выражение закона действующих масс (ЗДМ), который можно сформулировать следующим образом:
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 953; Нарушение авторских прав?; Мы поможем в написании вашей работы!