
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константа диссоциации слабого электролита
|
|
|
|
Процесс диссоциации молекул электролита является обратимым. В растворе устанавливается равновесие между ионами и недиссоциированными молекулами. Поэтому можно использовать ЗДМ. Допустим, что ионизация слабого электролита протекает по схеме
АВ↔А++ В-.
Если обозначить равновесную концентрацию недиссоциированных молекул [AB], а концентрацию ионов соответственно [A+] и [B-], то константа равновесия примет вид

Константа равновесия, отвечающая диссоциации слабого электролита, называется константой диссоциации. Ее величина зависит от природы электролита и растворителя, от температуры, но не зависит от концентрации раствора. Она характеризует способность данного электролита распадаться на ионы. Чем больше константа диссоциации, тем сильнее диссоциирует слабый электролит и тем выше концентрация его ионов в растворе. Принято обозначать константы диссоциации кислот символом Ка, оснований – Кв. Например, реакцию диссоциации уксусной кислоты можно представить уравнением
CH3COOH ↔ H+ + CH3COO-
Константа равновесия этой реакции (константа кислотности) имеет вид

Многоосновные кислоты, а также основания двух- и более валентных металлов диссоциируют ступенчато. В растворах этих веществ устанавливается сложные равновесия, в которых участвуют ионы различного заряда. Например, диссоциация угольной кислоты происходит в две ступени:
H2CO3 ↔ H++HCO3-
HCO3- ↔ H+ +CO32-.
Каждое уравнение характеризуется своей константой диссоциации. Для первой реакции ее обозначают К1, для второй – К2.
 ,
, 
Суммарному равновесию
H2CO3 ↔ 2H+ + CO32-
отвечает суммарная константа диссоциации К

Величины К, К1 и К2 связаны друг с другом соотношением К = К1×К2.
|
|
|
При ступенчатой диссоциации веществ распад до последней ступени всегда происходит в меньшей степени, чем по предыдущей. Иначе говоря, соблюдается неравенство
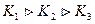 …..
…..
Это объясняется тем, что энергия, которую нужно затратить для отрыва иона, минимальна при его отрыве от нейтральной молекулы и становится больше при диссоциации по каждой следующей ступени.
Если обозначить концентрацию электролита, распадающегося на два иона, через с, а степень его диссоциации в данном растворе через α, то концентрация каждого из ионов будет с∙α, а концентрация недиссоциированных молекул с∙(1 - α). Тогда уравнение константы диссоциации принимает вид
 , или
, или  .
.
Это уравнение выражает закон разбавления Оствальда. Оно дает возможность вычислять степень диссоциации при различных концентрациях электролита, если известна его константа диссоциации, или вычислять константу диссоциации электролита, зная его степень диссоциации при той или иной концентрации.
Для растворов, в которых диссоциация электролита очень мала, т.е. α<<1 уравнение закона Оствальда упрощается:
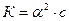 , или
, или 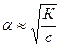 .
.
Это уравнение наглядно показывает связь, существующую между концентрацией слабого электролита и степенью его диссоциации: при разбавлении степень диссоциации увеличивается.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 705; Нарушение авторских прав?; Мы поможем в написании вашей работы!