
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы химической связи
|
|
|
|
К основным типам химической связи относят ковалентную (полярную и неполярную), ионную и металлическую связи.
Ковалентной связью называют химическую связь, образованную путем обобществления пары электронов двумя атомами неметаллов. Если связь образована между двумя одинаковыми атомами, то образуется ковалентная неполярная связь. В этом случае электронная плотность общей пары равномерно распределена между атомами (например, H - H; O = O; N º N). Если связь образована между двумя разными атомами, то образуется ковалентная полярная связь и более электроотрицательный атом сильнее притягивает общую пару электронов (например, Н2О). При этом у данного атома (О) повышается плотность отрицательного заряда, который получил название отрицательного эффективного заряда (-d). У второго атома (Н) повышается плотность положительного эффективного заряда (+d).
Особенностями ковалентной химической связи является насыщаемость, направленность и поляризуемость.
Насыщаемость ковалентной связи обусловлена ограниченными валентными возможностями атомов, т.е. их способностью к образованию строго определенного числа связей, которое обычно лежит в пределах от 1 до 6. Общее число валентных орбиталей в атоме, т.е. тех, которые могут быть использованы для образования химических связей, определяет максимально возможную валентность элемента. Число уже использованных для этого орбиталей определяет валентность элемента в данном соединении. Если атом образует все связи только за счет спаривания электронов, то обычно говорят просто о валентности, которая определяется числом одноэлектронных орбиталей, или числом неспаренных электронов его атома в основном или возбужденном состоянии.
|
|
|
Направленность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счет возможно большей плотности между ядрами. Это достигается при такой пространственной направленности перекрывания электронных облаков, которая совпадает с их собственной. Исключение составляют s-электронные облака, поскольку их сферическая форма делает все направления равноценными.
Поляризуемость рассматривают на основе представлений о том, что ковалентная связь может быть неполярной (чисто ковалентной) или полярной. В первом случае симметричное распределение электронной плотности в межъядерном пространстве приводит к совпадению центров тяжести положительных и отрицательных зарядов; во втором случае межъядерная электронная плотность смещается к атому с большей ЭО.
Ионной называют связь, если при полном смещении межъядерной электронной плотности к атому с большей ЭО атомы превращаются в положительно и отрицательно заряженные ионы, между которыми действуют силы электростатического притяжения. Полного, т.е. стопроцентного, смещения электронной плотности к атому с большей ЭО не происходит даже в наиболее ионных соединениях, которыми являются бинарные соединения щелочных металлов с галогенами (например, NaF, NaСl, КСl).
Это объясняется как волновыми свойствами электронов, так и влиянием зарядов образовавшихся ионов на электронные оболочки друг друга, т.е. их взаимной поляризацией. Принято считать связь ионной, если изменение ЭО > 1,9. Ионная связь образуется между катионами s-металлов I и II групп периодической системы и ионами р-неметаллов VI и VII групп (NaF, КСl, Nа2O и др.). При этом у катионов и ионов образуются устойчивые октетные электронные конфигурации:
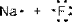
| ® | 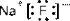
|
3s0 2s22p6
(фторид натрия состоит из ионов натрия Na+ и фторид-ионов F-)
Ионная связь, в отличие от ковалентной, характеризуется: ненаправленностью, так как сферическое поле вокруг ионов во всех направлениях равноценно; ненасыщаемостью, поскольку при взаимодействии ионов не происходит полной компенсации их силовых полей; координационными числами в ионных соединениях, которые определяются не электронной структурой атомов, а соотношением радиусов взаимодействующих ионов. Так, отношение радиуса иона натрия к радиусу иона хлора равно:
|
|
|
r(Na+)/r(Cl-) = 0,098/0,0181 = 0,54.
Это значение лежит в пределах 0,41 – 0,73, что определяет октаэдрическую координацию ионов, которая характеризует кристаллическую решетку хлорида натрия.
Таким образом, химическая связь в большинстве химических соединений сочетает свойства ковалентной и ионной связи. Поэтому ее можно считать ковалентной с определенной долей ионности.
Механизмов образования ковалентной химической связи два: обменный и донорно-акцепторный. При обменном механизме образования химической связи неспаренные электроны одного атома взаимодействуют с неспаренными электронами другого атома.
| H• + •H ® H: H | или | 
| ® | 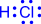
|
При донорно-акцепторном механизме общая электронная пара образуется за счет неподеленной пары электронов одного атома (донора) и вакантной орбитали другого атома или иона (акцептора). Например, образование иона аммония из растворенного в воде газообразного аммиака:
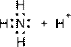
| ® | 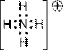
|
Независимо от способа образования, все четыре связи в ионе аммония равноценны (по энергии связи, длине, направленности, полярности).
Металлическая связь проявляется при взаимодействии атомов элементов, имеющих избыток свободных валентных орбиталей по отношению к числу валентных орбиталей электронов. К такому типу химической связи относятся металлы и их сплавы. В металлах электроны приобретают способность свободно перемещаться между ядрами в пространстве именно благодаря относительно высокой «концентрации» свободных орбиталей. В результате этого в решетке металлов возникают свободные электроны (электронный газ), которые непрерывно перемещаются между положительными заряженными ионами, электрически их притягивают и обеспечивают стабильность решетки металлов.
Необходимо отметить, что переходные металлы способны между собой образовывать ковалентную связь, что приводит к повышению температуры плавления. В целом энергия образования металлической связи является промежуточной между энергиями ковалентных и молекулярных кристаллов. Особенности металлической связи объясняют такие свойства металлов, как электропроводность, ковкость, пластичность, блеск и т.д.
|
|
|
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 446; Нарушение авторских прав?; Мы поможем в написании вашей работы!