
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика жидкого состояния вещества
Рис. 3. Изотерма реального газа
Свойства газовых смесей. В технике часто используются различные смеси газов. Многие из них являются хорошим газообразным топливом (природный, доменный, генераторный газы); некоторые служат ценным химическим сырьем и широко используются при синтезе ряда веществ (нефтяные газы, воздух, коксовый газ и др.). Если газовая смесь подчиняется законам идеальных газов, то она называется идеальной газовой смесью. Реальные газовые смеси отклоняются от идеальных газов тем сильнее, чем выше их плотность (ниже температура и выше давление).
Основным законом идеальных газовых смесей является закон Дальтона: общее давление газовой смеси, состоящей из газов, химически не взаимодействующих друг с другом (pобщ.), равно сумме парциальных давлений всех входящих в нее газов (p1, p2, p3,… pi):
pобщ. = p1 + p2 + p3 +…+ pi. (3.9)
Парциальное давление равно тому давлению идеального газа, которым он обладал бы, если бы занимал тот же объем, при той же температуре, что и газовая смесь. В смеси идеальных газов к каждому отдельному газу может быть применено уравнение состояния и законы идеального газа. Для газовых смесей в области высоких давлений и низких температур закон Дальтона становится неточным.
Жидкости по своим свойствам занимают промежуточное положение между газообразными и твердыми телами. Вблизи точки кипения они проявляют сходство с газами: текучи, не имеют определенной формы, аморфны и изотропны, то есть, однородны по своим свойствам в любом направлении. С другой стороны жидкости, как и твердые тела, обладают объемной упругостью, они упруго противодействуют как всестороннему сжатию, так и всестороннему растяжению. Молекулы их стремятся к некоторому упорядоченному расположению в пространстве, то есть, жидкости имеют зачатки кристаллической структуры («ближний порядок»). Подобные свойства особенно проявляются вблизи температуры замерзания.
Наличие «ближнего порядка» жидкостей связано с особенностями теплового движения частиц в них: жидкости обладают более рыхлой структурой по сравнению с твердыми телами. В жидкостях всегда есть свободные места – «дырки», благодаря которым молекулы могут перемещаться, покидая свое место и занимая одну из свободных «дырок». На новом месте каждая молекула в течение некоторого промежутка времени совершает колебательные движения около определенной точки равновесия, затем вновь перемещается в свободную «дырку» и т.д. Таким образом, тепловое движение молекул в жидкости совершается в виде сравнительно резких перемещений этих молекул из одних временных положений в другие и тепловых колебаний в промежутках между перемещением. Именно по этой причине жидкости отличаются высокой текучестью и принимают форму того сосуда, в котором находятся.
Жидкости не подчиняются законам идеальных газов, каждая жидкость характеризуется рядом физических величин: плотностью (r, г/см – масса в единице объема); температурой кипения (tкип, 0С); температурой замерзания (tзам, 0С); поверхностным натяжением (s, Н/м – это работа необходимая для создания новой площади поверхности); вязкостью (h, Па • с – это сопротивление жидкости текучести, по особенностям вязкости жидкости делятся на ньютоновские и структурированные); испарением (характеризует переход молекул жидкости в газообразное состояние, за счет более высокой кинетической энерги, и способностью преодолеть силы молекулярного взаимодействия: вандервальсовы и водородные); способностью образовать ассоциаты (димеры, тримеры), что приводит к повышению температуры кипения, коэффициента преломления, повышению теплоемкости, например у воды, жидкого аммиака, серной кислоты; существуют и другие свойства жидкостей, зависящие от их природы и природы растворенных в них веществ.
Некоторые вещества в жидком состоянии обладают высокой степенью упорядоченности – это кристаллические жидкости, или жидкие кристаллы, которые, как и кристаллические вещества, обладают анизотропными свойствами, то есть, их свойства по различным направлениям различны. Такие системы занимают промежуточное положение между жидким и твердым состоянием. Они обладают текучестью, но имеют дальний порядок – упорядоченность расположения частиц по всему объему. Это связано со строением молекул: они сильно вытянуты, и подобранная форма сильно затрудняет вращение молекул в жидкости и способствует их более упорядочному расположению:
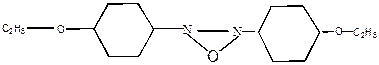
При плавлении кристаллов таких веществ сначала образуется кристаллическая жидкость, которая при дальнейшем повышении температуры превращается в обычную изотропную жидкость. Примеры жидких кристаллов: азосоединения, производные коричной кислоты, азалитинов и стероидов. Их используют для изготовления экранов дисплеев, микрокалькуляторов, циферблатов часов, измерительных приборов в медицине и т.д.
3.4. Характеристика твёрдого состояния
Как известно, при достаточно низкой температуре все вещества переходят в твердое состояние. Частицы твердых тел настолько прочно связаны друг с другом силами взаимного притяжения, что для них исключается поступательное движение и имеет место лишь колебательное движение около определенных точек. Под действием внешних сил эти частицы могут несколько смещаться из своего первоначального положения, но при снятии нагрузки они вновь возвращаются в него обратно. Таким образом, для всякого твердого тела характерна не только собственная форма, но и способность к деформации. Деформация – это способность твердого вещества восстанавливать прежнюю форму после снятия действия сил, направленных на ее изменение. По способности к деформации все тела разделяются на упругие, пластичные и хрупкие.
Твердые тела обычно делят на две группы: кристаллические вещества и аморфные. Кристаллические вещества имеют четкую внутреннюю структуру, что связано с правильным расположением частиц в строго периодически повторяющемся порядке, а с этим связаны следующие свойства:
а) для каждого твердого кристаллического тела есть строго постоянная температура плавления;
б) для монокристаллов (одиночные кристаллы) характерно явление анизотропии, то есть, свойства кристаллов в различных направлениях неодинаковы (тепло и электропроводность, механическая прочность, коэффициент теплового расширения, скорость растворения и т.д.). Для поликристаллов (реальных) это явление не проявляется;
в) кристаллы характеризуются энергией кристаллической решётки – той энергией, которая необходима для разрушения кристаллической структуры (кДж/моль).
|
|
Дата добавления: 2013-12-12; Просмотров: 1085; Нарушение авторских прав?; Мы поможем в написании вашей работы!