
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Понятие о химическом сродстве веществ. Уравнения изотермы, изобары и изохоры химических реакций
|
|
|
|
Под термином «химическое сродство» понимают способность веществ вступать в химическое взаимодействие друг с другом. У различных веществ оно зависит от природы реагирующих веществ, концентрации или давления (для газов) и температуры. За меру химического сродства приняли изменение термодинамических потенциалов: изменение энергии Гиббса (DG) и изменение энергии Гельмгольца (DF). При постоянной температуре химическое сродство считают по уравнениям Вант-Гоффа, которые называются уравнением изотермы химической реакции. Для газовых смесей она имеет вид:
DG = RT(ln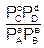 – lnKР), (6.16)
– lnKР), (6.16)
a для газовых смесей и растворов:
DF = RT(ln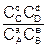 – lnKС), (6.17)
– lnKС), (6.17)
где DG и DF – изменение энергии Гиббса и энергии Гельмгольца, Дж/моль; PA, PB, PC, PD и СА, СВ, СС, СD – неравновесные давления и концентрации участников реакции, Па и моль/дм3, соответственно;
КР и КС – константы равновесия, содержащие равновесные давления и концентрации.
Уравнения (6.16) и (6.17) применяют для идеальных газовых смесей или разбавленных растворов. При стандартных условиях эти уравнения имеют вид:
DG0 = 2,303RT(Dnlg101325 – lgКР) (6.18)
DF0 = -2,303RTlgКС (6.19)
Уравнения (6.17) – (6.19) позволяют определить, каким должны быть температура и состав исходной реакционной смеси, чтобы реакция протекала в нужном направлении и требуемой степени.
Как отмечалось в теме 4, если DF или DG < 0, то процесс идет самопроизвольно в прямом направлении; если DF или DG > 0, то процесс идет самопроизвольно в обратном направлении; если DF или DG = 0, то это состояние химического равновесия.
Общеизвестно, что константа равновесия зависит как от природы реагирующих веществ, так и температуры. Зависимость константы равновесия от температуры можно вывести, используя первый и второй законы термодинамики и уравнения (6.18) и (6.19). Получим уравнения изобары (6.20) и изохоры (6.21) Вант-Гоффа (1884) в дифференциальном виде:
|
|
|
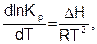 (6.20)
(6.20)
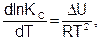 (6.21)
(6.21)
или в интегральной форме:
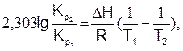 (6.22)
(6.22)
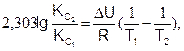 (6.23)
(6.23)
где DН и DU – тепловые эффекты химической реакции при постоянном давлении и объеме, соответственно. Из уравнений (6.22) и (6.23) видно, что константа равновесия экзотермической реакции уменьшается, а эндотермической реакции возрастает с повышением температуры.
Уравнения изохоры и изобары химической реакции позволяют количественно охарактеризовать смещение равновесия при изменении температуры, в то время как принцип Ле-Шателье дает только качественную характеристику сдвига равновесия.
Вопросы для самоконтроля:
1. Какие реакции относятся к обратимым, а какие к необратимым?
2. Каковы основные признаки химического равновесия.
3. Как формулируется закон действующих масс для равновесных систем?
4. Что собой представляет константа равновесия, ее физический смысл? От каких факторов она зависит?
5. Как по величине константы равновесия определить возможность протекания химического процесса?
6. Как формулируется принцип Ле-Шателье?
7. Каково влияние температуры на смешение химического равновесия?
8. Каково влияние давления на смешение химического равновесия гомогенных и гетерогенных процессов?
9. Каково влияние концентрации на смешение химического равновесия?
10. В чем заключается правило фаз Гиббса?
11. Что представляет собой диаграмма состояния воды?
12. Что понимают под термином «химическое сродство»?
13. Каково аналитическое выражение уравнения изотермы химической реакции для газовых смесей?
14. Каково аналитическое выражение уравнения изотермы химической реакции для растворов?
15. Каково аналитическое выражение уравнения изобары и изохоры Вант-Гоффа?
Вопросы для самостоятельной работы:
|
|
|
1. Правило фаз Гиббса; диаграмма состояния воды.
2. Химическое сродство веществ.
3. Уравнение изотермы химических реакций.
4. Уравнение изобары химических реакций.
5. Уравнение изохоры химических реакций.
Литература:
1. Семенова Е. В., Кострова В. Н., Федюкина У. В. Химия. – Воронеж: Научная книга – 2006, 284 с.
2. Коровин Н.В. Общая химия. - М.: Высш. шк. – 1990, 560 с.
3. Глинка Н.Л. Общая химия. – М.: Высш. шк. – 1983, 650 с.
4. Глинка Н.Л. Сборник задач и упражнений по общей химии. – М.: Высш. шк. – 1983, 230 с.
5. Ахметов Н.С. Общая и неорганическая химия. М.:Высшая шк. – 2003, 743 с.
6. Угай Я.А. Общая и неорганическая химия. - М.: Высш. шк. – 1997, 550 с.
7. Зайцев О.С. Общая химия. Направление и скорость химических процессов. Строение вещества. - М.: Высш. шк. – 1983, 250 с.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 773; Нарушение авторских прав?; Мы поможем в написании вашей работы!