
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. За исключением жидкого амида муравьиной кислоты (формамида), остальные амиды – кристаллические вещества
|
|
|
|
Физические свойства
За исключением жидкого амида муравьиной кислоты (формамида), остальные амиды – кристаллические вещества. Чистые амиды почти не имеют запаха. Низшие амиды растворимы в воде.
В амидах карбонильная группа эффективно сопряжена с амидной. При этом азот принимает sp2 -гибридное состояние и вместе со своими заместителями располагается в одной плоскости с карбонильной группой:
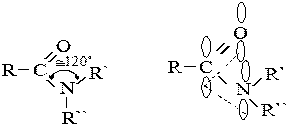 |
В такой конформации орбиталь неподеленной электронной пары азота оказывается параллельной р -орбитали карбонила, что обеспечивает р-p -сопряжение. –I -эффект амидной группы уступает +М -эффекту
Такое электронное строение определяет химические особенности амидов. Они плохо вступают в нуклеофильное присоединение по карбонильной группе.
Мезомерный сдвиг пары электронов атома азота приводит к резкому понижению его основности. Вследствие этого амиды протонируются в кислой среде по кислороду, а атомы водорода аминогруппы приобретают подвижность. Тем не менее амиды – слабые основания, они могут подвергаться типичным реакциям алкилирования (галоидными алкилами) и ацилирования (галогенангидридами или ангидридами кислот):
1. Алкилирование, ацилирование
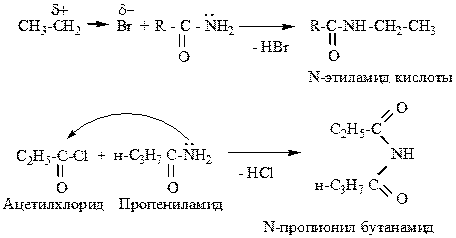 |
2. Гидролиз протекает при нагревании амидов с водными растворами кислот или оснований:
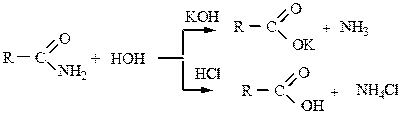 |
Под действием азотистой кислоты также образуется кислота.
3. Дегидратация амидов протекает под действием фосфорного ангидрида. Ее можно представить как изомеризацию амидов в гидроксиимин и отщепление от последнего воды с образованием нитрилов:
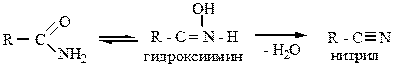 |
4. Реакция Гофмана. При действии на амиды гипогалогенида или брома и щелочи образуются амины, а углеродный атом карбонильной группы отщепляется в виде СО2:
|
|
|
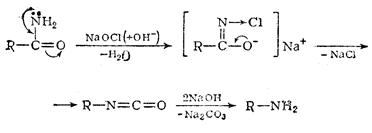 (Br2 + 2NaOH ® NaBr + NaOBr + H2O)
(Br2 + 2NaOH ® NaBr + NaOBr + H2O)
изоцианаты перв.амины
5. При действие пятихлористого фосфора образуются хлорамиды
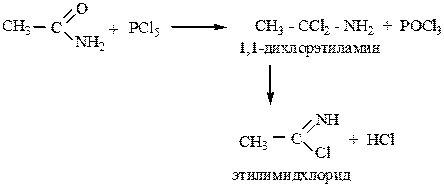 |
легко распадающиеся на имидхлориды и HCl
6. При восстановлении образуются первичные амины с тем же числом атомов углерода:
R – СО – NH2 + 4H ® R – CH2 – NH2 + H2O
6 Пероксиды ацилов. Надкислоты.
Пероксид водорода Н2О2.
В безводном состоянии не дает реакции на лакмусовую бумажку. В водном растворе дает кислую реакцию, однако константа ионизации перекиси водорода очень мала, на уровне константы ионизации фосфорной кислоты третьей ступени. Являясь слабой кислотой, может образовывать соли только с сильными основаниями, т.е. с гидрооксидами щелочных металлов (Na2O2, BaO2).
Н2О2 + Н2О «Н3+ + НОО-:
Н2О2 является сильным окислителем.
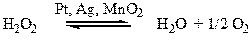 |
Разложение пероксида водорода ускоряется катализаторами:
Концентрированные растворы более устойчивые, чем разбавленные, сильно взрываются при попадании пыли. Следы щелочи, образующиеся при растворении стекла бутылки, ускоряют дальнейшее разложение Н2О2. На способности выделять атомарный кислород основано применение Н2О2 в медицине (дезинфицирующее средство), для отбеливания, окислитель в ракетных топливах и др.
 |
Атомы водорода в перекиси водорода могут быть замещены на органический радикал (алкил, ацил).
Органические производные пероксида водорода

1. Перекиси ацилов и надкислоты
При нагревании бурно взрываются, при хранении на холоду разлагаются с выделением кислорода. Поэтому являются сильными окислителями.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 772; Нарушение авторских прав?; Мы поможем в написании вашей работы!