
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакции на общие примеси (с.166, т.1 ГФXI)
 |
Растворимость
| Условные термины: | Количество растворителя для растворения 1г в-ва |
| очень легко растворим | до 1 |
| легко растворим | от 1 до 10 |
| растворим | от 10 до 30 |
| умеренно растворим | от 30 до 100 |
| мало растворим | от 100 до 1000 |
| очень мало растворим | от 1000 до 10 000 |
| практически не растворим | от 10 000 |
Cl-
Методика (из ГФ 11): к 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 0,5 мл азотной кислоты, 0,5 мл раствора нитрата серебра, перемешивают и через 5 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактивов, какое прибавлено к испытуемому раствору.
NaCl + AgNO3 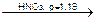 AgCl¯ + NaNO3
AgCl¯ + NaNO3
Выпадает белый творожистый осадок, белая муть или опалесценция, не исчезающая при добавлении HNO3, но исчезающая при добавлении NH4OH.
AgCl¯ + 2NH4OH à [Ag(NH3)]Cl + 2H2O
Среда кислая, т.к. в щелочной среде выпадает черный осадок:
2Ag+ + 2OH- à AgOH à Ag2O¯
Предел обнаружения – 0,1 мг
Эталон – прокаленный NaCl, С = 2 мкг Cl- в 1 мл
SO42-
Методика: к 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 0,5 мл разведенной хлористоводородной кислоты и 1 мл раствора хлорида бария, перемешивают и через 10 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактивов, какое прибавлено к испытуемому раствору
K2SO4 + BaCl2 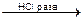 BaSO4¯ + 2KCl
BaSO4¯ + 2KCl
Белый осадок или муть, не исчезающая при добавлении HCl разведенной.
BaSO4 + H+ (минер. к-ты) ½
Испытываемый раствор должен иметь нейтральную среду: Ba2+ + 2OH- àBa(OH)2.
Среда должна быть солянокислой, т.к. в ней растворимы другие соли бария.
Эталон: K2SO4, высушенный при 100-150°С до постоянной массы. С = 0,01 мг/мл
|
|
|
NH4+
Первый способ (с реактивом Несслера):
Методика: к 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 0,15 мл реактива Несслера, перемешивают и через 5 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактива, какое прибавлено к испытуемому раствору. Окраска, появившаяся в испытуемом растворе, не должна превышать эталон.
NH4Cl + 2K[HgI4] à [I-Hg-NH2+-Hg-I]I-¯+ KCl + H2O
Исследуемый препарат должен иметь нейтральную или слабощелочную среду, так как в сильнощелочной среде:
NH4+ + OH-à NH3
Если исходная реакция среды кислая, то надо нейтрализовать, т.к. разрушится конечный комплекс.
Мешают ионы некоторых металлов – осадки гидроокисей. Их надо осадить.
Эталон: NH4Cl, высушенный в эксикаторе над H2SO4 до постоянной массы.
Второй способ (безэталонный):
Методика: 5 мл раствора испытуемого препарата, указанной в соответствующей частной статье концентрации, помещают в коническую колбу вместимостью 25 мл, прибавляют 5 мл раствора едкого натра. Сверху колбы помещают смоченную водой красную лакмусовую бумагу и закрывают часовым стеклом. Колбу ставят на водяную баню. Наблюдение проводят через 5 мин.
NH4+ + NaOH 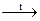 NH3 + H2O
NH3 + H2O
Определяют по запаху или по посинению красной лакмусовой бумажки.
Ca2+
Методика: К 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 1 мл раствора хлорида аммония, 1 мл раствора аммиака и 1 мл раствора оксалата аммония, перемешивают и через 10 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактивов, какое прибавлено к испытуемому раствору
В среде аммиачного буфера:
Ca2+ + (NH4)2C2O4 à(NH4OH, NH4Cl) CaC2O4¯ + 2NH4+
Выпадает белый мелкокристаллический осадок или белая муть, не исчезающая при прибавлении CH3COOH, но растворимая в HCl, HNO3.
|
|
|
В присутствии HCl, HNO3 идет обратная реакция.
Эталон: CaCO3, высушенный при 100-150°С до постоянной массы.
Fe3+/Fe2+
Методика: к 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 2 мл раствора сульфосалициловой кислоты и 1 мл раствора аммиака и через 5 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора В и такого же количества реактивов, какое прибавлено к испытуемому раствору.

Эталон: железоаммонийные квасцы FeNH4(SO4)•12H2O. Рабочий раствор В, а не Б. Сперва определяют содержание железа в железоаммонийных квасцах, титруя его тиосульфатом натрия. Исходя их концентрации установленной, готовят 0,1% раствор.
Zn2+
Методика: к 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 2 мл хлористоводородной кислоты, 5 капель раствора ферроцианида калия и через 10 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактивов, какое прибавлено к испытуемому раствору. Муть, появившаяся в испытуемом растворе, не должна превышать эталон.
Zn2+ + K4[Fe(CN)6] 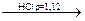 ZnK2[Fe(CN)6]¯ + 2K+
ZnK2[Fe(CN)6]¯ + 2K+
Белая муть, нерастворимая в разведенных кислотах, но растворимая в щелочах. Кислая среда увеличивает специфичность и чувствительность реакции к цинку. В щелочной среде образуется Zn(OH)2 (pH=10), ZnO22- (pH=13)
Если образуется синь, то препарат содержит большую примесь железа, значит его надо осадить в виде гидроокиси, отфильтровать.
Эталон: ZnO прокаливают до постоянной массы, растворяют в NHO3.
Pb2+
Методика: К 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 1 мл разведенной уксусной кислоты, 2 капли раствора сульфида натрия, перемешивают и через 1 мин сравнивают с эталоном, состоящим из 1 мл эталонного раствора Б, такого же количества реактивов, какое прибавлено к испытуемому раствору, и 9 мл воды
Pb2+ + S2- à PbS¯ (черный осадок)
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 845; Нарушение авторских прав?; Мы поможем в написании вашей работы!