
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Понятие химического потенциала
|
|
|
|
Фундаментальное уравнение Гиббса для открытых систем
8.1. Дифференциалы характеристических функций
dU = TdS – pdV - dW’
Гиббс ввел в качестве переменной массу, а точнее количество молей компонентов, т.е. для открытых систем нужно учесть химическую работу, которую можно представить как обмен веществом с окружающей средой.
dWхим. = - 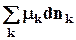 .
.
dU = TdS – pdV + 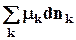 . U = f (S, V, nk) (8.1)
. U = f (S, V, nk) (8.1)
dН = TdS + Vdp + 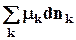 . H = f (S, p, nk) (8.2)
. H = f (S, p, nk) (8.2)
dA = - SdT – pdV + 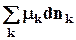 . A = f (V, T, nk) (8.3)
. A = f (V, T, nk) (8.3)
dG = Vdp –SdT + 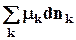 . G = f (p, T, nk) (8.4)
. G = f (p, T, nk) (8.4)
mka - химический потенциа л всегда является интенсивной характеристикой состояния компонента k в фазе a.
Химический потенциал k –компонента в фазе a показывает изменение любой характеристической функции при введении в систему (фазу) 1 моля k-вещества при постоянных естественных параметрах данной характеристической функции и неизменном количестве других компонентов (или при неизменном составе фазы), его можно также определить как работу, которую нужно затратить на введение в систему 1 моля k-вещества при указанных условиях.
mk = 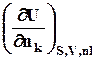 =
= 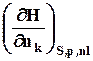 =
=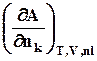 =
=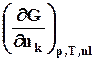 . (8.5)
. (8.5)
Наиболее часто используется именно последнее выражение химического потенциала через энергию Гиббса.
8.3. Интегрирование фундаментального уравнения Гиббса (8.1) по числу молей при постоянных температуре, давлении и составе. Будем увеличивать число молей в системе от нуля до n. В фундаментальном уравнении в качестве независимых переменных выступают экстенсивные величины, которые зависят от числа молей. Если n = 0, то и все экстенсивные переменные имеют в качестве нижнего предела 0.
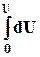 = T
= T 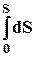 – p
– p 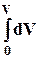 dV +
dV + 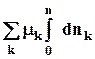
 (8.6)
(8.6)
U = TS – pV + Smknk. (8.7)
H = U + pV = TS + Smknk (8.8)
A = U –TS = -pV + Smknk (8.9)
G = U + pV – TS = Smknk (8.10)
Если система однокомпонентная, то уравнение (8.10) вовсе упрощается
|
|
|
G = mn. (8.11)
| m = G/n = G Þ(8.12) Химический потенциал чистого вещества численно равен мольной энергии Гиббса. |
Отсюда вытекает важное следствие:
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 416; Нарушение авторских прав?; Мы поможем в написании вашей работы!