
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон Дальтона
Законы идеального газа
Молекулярно кинетическая теория идеальных газов
Идеальным называется газ удовлетворяющий следующим условиям: 1) сила взаимодействия между молекулами газа малы. Соударение между молекулами газа и молекулами сосуда являются обсолютно упругими. Объём молекул газа значительно меньше объёма сосуда. Поэтому под объёмом газа понимается объём сосуда в котором находится газ.
Идеальный газ описывается с помощью следующих параметров: Давление, объём, масса, и температура. Под давлением понимается давление газа которое осуществляют молекулы газа на стенки сосуда. Объём - объём сосуда в котором находится газ. Масса – масса молекул газа.
Для изучения свойств идеального газа были проделаны эксперименты на основании которых были получены опытные законы идеального газа. В данных экспериментах проводившихся при постоянной массе идеального газа, фиксировался один из параметров данного идеального газа (Изобарический, изохорический, изотермический)
Все опытные законы могут быть обобщены с помощью уравнения Менделеева клаперона.
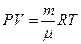
R – универсальная газовая постоянная = 8,31 Дж/моль*К
Μ – молярная масса (масса одного моля вещества тоесть такого количесва вещества которое содержит столько молекул сколько содержится в 12 граммах изотопа углерода с атомным весом 12. Na=6.022*10²³моль)
Если ввести постоянную вольтсмана которая связана с универсальной газовой постоянной.
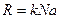
К=1,38*10¯²³Дж/К
То уравнение Менделеева-клаперона
P=nkT
n – концентрация молекул (число молекул в единице объёма) n=N/V.
Гласит, что если в некотором объёме находится смесь идеальных газов, то общее давление которое осуществляет данная смесь на стенки сосуда будет равно сумме парциальных давлений каждого из газов входящих в данную смесь. Парциальны называется такое давление которое осуществляет как бы один из газов находящихся в смеси если бы только он один находился в данном сосуде.
|
Дата добавления: 2013-12-12; Просмотров: 296; Нарушение авторских прав?; Мы поможем в написании вашей работы!