
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Условия равновесия фаз. Фазовые диаграммы
|
|
|
|
Фазовые переходы II рода
Фазовый переход II рода не связан с поглощением или выделением теплоты, происходит без теплообмена. В основе фазовых превращений II рода лежит изменение симметрии кристаллической решетки вещества без изменения типа этой решетки. Свойства таких переходов существенно отличны от свойств фазовых переходов I рода.
Он характеризуется постоянством объёма и энтропии, но скачкообразными изменениями теплоёмкости. Согласно Ландау этот переход связан с изменениями симметрии: выше точки перехода система, как правило, обладает более высокой симметрией, чем ниже точкой перехода.
Основные свойства переходов II рода:
· отсутствует скрытая теплота перехода;
· плотности фаз одинаковы;
· перестройка старой фазы в новую происходит постепенно и появление новой фазы не носит скачкообразный характер;
· при однородных распределениях температуры и давления исключены ситуации, когда одни части тела находятся в старой фазе, а другие – в новой;
· не существует состояний с равновесием фаз, фазовые состояния всех частей тела одинаковы;
· отсутствуют метастабильные состояния, в которых при температуре и давлении, соответствующем одной фазе, в течение некоторого времени существует другая фаза, нестабильная в этих условиях.
К фазовым переходам II рода относятся:
· переход ферромагнетика в парамагнитное состояние
выше точки Кюри;
· переход антиферромагнетиков в парамагнитное
состояние (хром, марганец, некоторые редкоземельные
элементы) выше температуры Неля;
· переход от упорядоченного расположения атомов
к разупорядоченному кристаллической решетки
|
|
|
медно-цинкового сплава при повышении температуры.
Для наглядного представления фазовых превращений используется диаграмма, на которой в координатах Р-Т задаётся зависимость между температурой фазового перехода и давлением в виде кривых испарения (КИ - кривая испарения), плавления (КП -кривая плавления) и сублимации (КС - кривая сублимации). Эти зависимости делят поле диаграммы на три области, соответствующие условиям существования твёрдой (ТТ - твёрдое тело), жидкой (Ж) и газообразной (Г) фаз.
Кривые на диаграмме называются кривыми фазового равновесия, каждая точка на них соответствует условиям равновесия двух сосуществующих фаз: КП – твёрдого тела и жидкости, КИ – жидкости и газа, КС – твёрдого тела и газа.
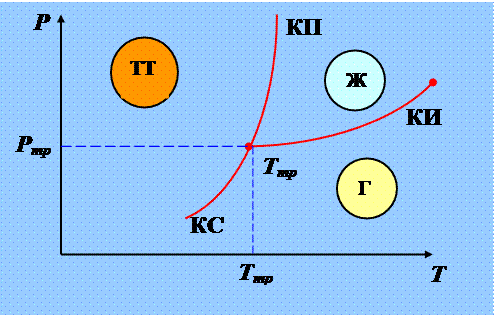

Тройная точка – точка, в которой пересекаются эти кривые и которая определяет условия (Ттр и Ртр) одновременного равновесного сосуществования трёх фаз вещества. Каждое вещество имеет только одну тройную точку (для воды это 273.16°К или 0.01°С).
Термодинамика позволяет рассчитать условия равновесия двух фаз одного и того же вещества.
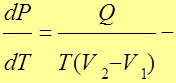 уравнение Клапейрона-Клаузиуса.
уравнение Клапейрона-Клаузиуса.
Q – теплота фазового перехода.
(V2 – V1) – изменение объёма вещества при переходе его первой фазы во вторую.
Т – температура перехода (процесс изотермический).
Уравнение Клапейрона-Клаузиуса позволяет определить наклоны кривых равновесия. Т.к. Q и T положительны, наклон задаётся знаком (V2 - V1).
При испарении жидкостей и сублимации Т.Т. объём вещества всегда возрастает, поэтому 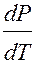 > 0 и в этих процессах рост Т приводит к росту Р и наоборот.
> 0 и в этих процессах рост Т приводит к росту Р и наоборот.
При плавлении большинства веществ объём, как правило, возрастает, т.е. 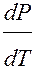 > 0, следовательно рост Р приводит к повышению температуры плавления Т. Для некоторых веществ (вода, Ge, чугун и др.) объём жидкой фазы меньше объёма твёрдой фазы
> 0, следовательно рост Р приводит к повышению температуры плавления Т. Для некоторых веществ (вода, Ge, чугун и др.) объём жидкой фазы меньше объёма твёрдой фазы 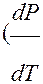 < 0
< 0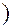 , следовательно увеличение давления приводит к понижению температуры плавления.
, следовательно увеличение давления приводит к понижению температуры плавления.
|
|
|
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 386; Нарушение авторских прав?; Мы поможем в написании вашей работы!