
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение изотермы системы. Связь энергии Гиббса с химическим потенциалом компонентов реакции
Рассмотрим химическую реакцию, протекающую при постоянном давлении и температуре.
Объединенное уравнение I и II Закона Термодинамики
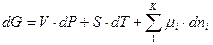
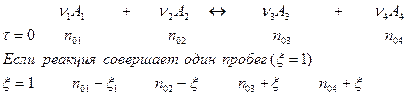
В общем случае, когда стехиометрические коэффициенты не равны единице, 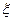 надо умножить на них:
надо умножить на них:
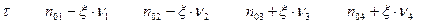
Поэтому, в общем случае, количество вещества в момент равновесия будет определяться:
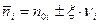
Переходя к объединенному уравнению I и II Закона Термодинамики:
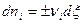
В изобарно-изотермических условиях 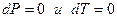 , следовательно
, следовательно 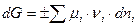
Переходя к конечным приращениям: 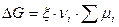 .
.
В данном случае, под понятием суммы имеется в виду термодинамическая сумма, в которой слагаемые, отвечающие исходным веществам, берутся со знаком «-», а слагаемые, отвечающие продуктам, со знаком «+». Данное выражение содержит величину 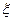 , то есть число пробегов химической реакции, или степень завершенности химической реакции.
, то есть число пробегов химической реакции, или степень завершенности химической реакции.
величина 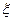 , как число пробегов химической реакции, может быть любым неотрицательным числом. Величина будет являться таковой, если начальное количество веществ больше стехиометрических коэффициентов:
, как число пробегов химической реакции, может быть любым неотрицательным числом. Величина будет являться таковой, если начальное количество веществ больше стехиометрических коэффициентов: 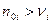
Величина 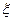 , как степень завершенности химической реакции лежит в интервале [0;1]. Данный случай реализуется, когда
, как степень завершенности химической реакции лежит в интервале [0;1]. Данный случай реализуется, когда 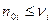 . В этом случае, если
. В этом случае, если 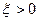 , реакция идет в прямом направлении; если
, реакция идет в прямом направлении; если 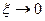 , реакция находится в состоянии равновесия.
, реакция находится в состоянии равновесия.
Если 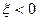 , с точки зрения термодинамики не имеет физического смысла, однако при расчете некоторых химических равновесий может показывать, что процесс идет в обратную сторону.
, с точки зрения термодинамики не имеет физического смысла, однако при расчете некоторых химических равновесий может показывать, что процесс идет в обратную сторону.
Критерием направленности процессов в системах с переменным составом должно оставаться изменение энергии Гиббса (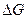 ), однако
), однако 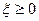 , поэтому критерием направленности служит
, поэтому критерием направленности служит 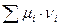 :
:
1. Если 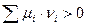 , следовательно
, следовательно 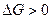 (не самопроизвольный процесс)
(не самопроизвольный процесс)
2. Если 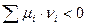 , следовательно
, следовательно 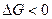 (самопроизвольный процесс)
(самопроизвольный процесс)
3. Если 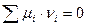 , следовательно
, следовательно 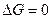 (система находится в состоянии равновесия)
(система находится в состоянии равновесия)
Очевидно, что расчет термодинамической суммы химических потенциалов прямыми методами не возможен, поэтому расчет изменения 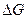 в закрытых системах с переменным составом проводится косвенными методами!
в закрытых системах с переменным составом проводится косвенными методами!
|
|
Дата добавления: 2013-12-12; Просмотров: 434; Нарушение авторских прав?; Мы поможем в написании вашей работы!