
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическое равновесие в гетерогенных системах
|
|
|
|
Система называется гетерогенной, если в ней присутствует несколько агрегатных состояний вещества одновременно. В этом случае запись константы равновесия будет иметь особенности.
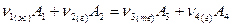
Условие химического равновесия в закрытых системах с переменным составом: 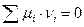
Химический потенциал 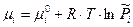
Однако, для конденсированных систем 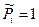 , следовательно
, следовательно 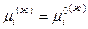 ,
, 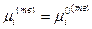
Запишем условие химического равновесия:
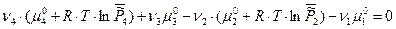
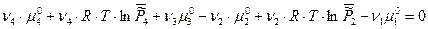
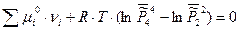
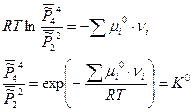
Таким образом, для гетерогенных реакций, выражение для К0 будет включать в себя стандартные химические потенциалы всех участников реакции, но произведение относительных парциальных давлений в момент равновесия будет содержать только произведение только газообразных участников реакций, поэтому для некоторых процессов формальная запись констант равновесия может быть одинаковой, например:
I. 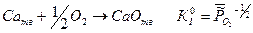
II. 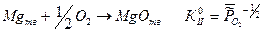
В момент равновесия давление кислорода в системе будет характеризоваться разным давлением, так как термодинамическая константа равновесия включает в себя стандартные химические потенциалы всех участников реакции.
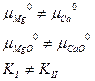
Лекция №7
План лекции:
- Химическое сродство. Уравнение изотермы химической реакции.
- Влияние температуры на химическое равновесие. Уравнение изобары.
- Приближенное интегрирование уравнения изобары.
- Точное интегрирование уравнения изобары. Уравнение Темкина-Шварца.
- Расчет констант равновесия по приведенным энергиям Гиббса.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 390; Нарушение авторских прав?; Мы поможем в написании вашей работы!