
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет равновесной степени превращения и состава реакционной смеси
Расчет констант равновесия по приведенным энергиям Гиббса
Точное интегрирование уравнения изобары. Уравнение Темкина-Шварца
Данный вид интегрирования учитывает зависимость теплового эффекта от температуры и использует температурные ряды теплоемкости.
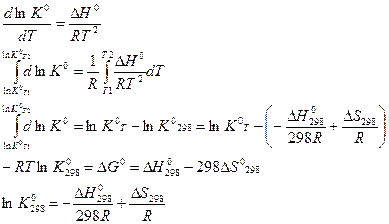
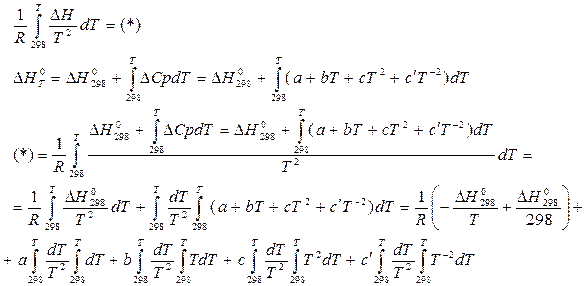
Таким образом, решая всю эту красоту, сокращая все, что сокращается, приводя подобные слагаемые, если это возможно и делая другого рода простые операции, данное уравнение преображается до вида:
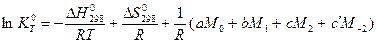
Где  - двойные интегралы по температуре. Они табулированы и рассчитаны через каждые 100К.
- двойные интегралы по температуре. Они табулированы и рассчитаны через каждые 100К.
Данный расчет строиться на уравнении нормального сродства и определении приведенной энергии Гиббса.
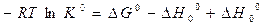 ,
,
Где 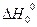 - тепловой эффект гипотетической реакции, протекающей при абсолютном нуле температуры.
- тепловой эффект гипотетической реакции, протекающей при абсолютном нуле температуры.
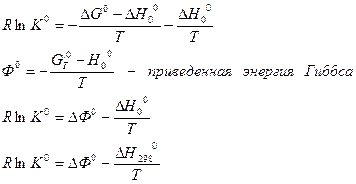
Данный метод получил широкое распространение в связи с развитием ракетной техники и необходимостью расчета химических равновесий при высоких температурах.
Лекция №8
План лекции:
- Расчет равновесной степени превращения и состава реакционной смеси.
- Влияние внешних факторов на смещение равновесия.
- Химическая термодинамика реальных систем.
- Понятие активности.
- Теория сильных электролитов Дебая-Хюккеля.
Данный вопрос является ключевым вопросом химической термодинамики.
Равновесная степень превращения 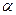 :
:
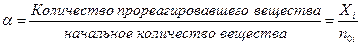
Расчет химического равновесия складывается из нескольких стадий:
- определение константы равновесия при определенной температуре.
- Формальная запись константы равновесия через относительные парциальные давления.
- Выражение относительных парциальных давлений через имеющиеся данные с использованием степени завершенности химического процесса, степени превращения
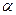 , начального количества вещества, степени прореагирующего вещества
, начального количества вещества, степени прореагирующего вещества 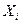 и так далее (
и так далее (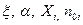 )
) - Решение полученного уравнения с одним неизвестным относительно однрго неизвестного.
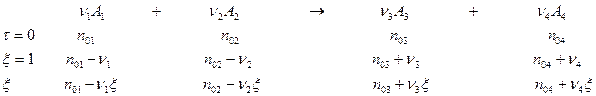
Для перехода к записи константы равновесия необходимо рассчитать мольные доли:
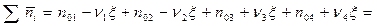 - сумма всех моль в системе.
- сумма всех моль в системе.
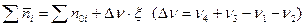
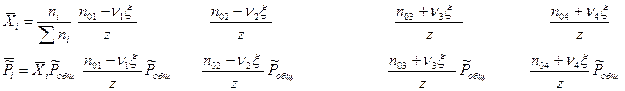

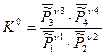
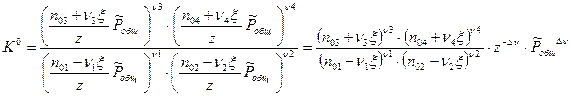
Количество корней данного уравнения может быть разным. Чаще всего физически обоснованным является один корень, который и требуется найти.
Данное уравнение позволяет не только рассчитать стехиометрический состав реакционной смеси, но и определить число пробегов химической реакции, степень превращения и оценить влияние внешних факторов на смещение равновесия.
|
|
Дата добавления: 2013-12-12; Просмотров: 4273; Нарушение авторских прав?; Мы поможем в написании вашей работы!