
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая термодинамика реальных систем
 |
Влияние внешних факторов на смещение равновесия
- Влияние температуры – уравнение изобары и свойства термодинамических потенциалов.
- Влияние давления – эмпирические константы равновесия (
 )
) - Влияние состава реакционной смеси – уравнение изотермы.
В зависимости от количества исходных веществ по отношению к стехиометрическому соотношению, степень превращения индивидуального вещества будет:
1. Больше, если вещество взято в недостатке. 
2. Меньше, если вещество взято в избытке. Максимальная степень превращения по обоим веществам будет наблюдаться, если оба вещества взяты в стехиометрических соотношениях.
При выводе основных уравнений химической термодинамики было замечено, что большинство из них работает либо в идеальных газах, либо в идеальных растворах. При переходе к реальным системам данные уравнения не описывают имеющиеся закономерности.
В связи с этим было предложено два подхода:
1. Подход Ван-дер-Ваальса, который предложил заменить имеющиеся термодинамические уравнения более сложными, которые учитывали бы объем молекулы, наличия взаимодействия между молекулами и так далее. В этом случае уравнение идеального газа, по его мнению, выглядело бы следующим образом: 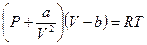
 - константа, характеризующая взаимодействие между частицами не идеального газа.
- константа, характеризующая взаимодействие между частицами не идеального газа.
 - константа, учитывающая собственный объем частицы.
- константа, учитывающая собственный объем частицы.
Однако, при этом подходе уравнения химической термодинамики значительно усложняются, поэтому общепринятым стал второй подход.
2. Подход Льюиса, который предложил оставить форму термодинамических уравнений неизменными, но изменить смысл входящих туда величин. В этом случае уравнение химического потенциала согласно Льюису выглядит следующим образом:
|
|
|
 ;
;  - исправленное давление, таким образом, чтобы уравнение для химического потенциала сохранило свою форму. Величина
- исправленное давление, таким образом, чтобы уравнение для химического потенциала сохранило свою форму. Величина  носит название фугитивность (летучесть)
носит название фугитивность (летучесть)
 по физическому смыслу, фугитивность – это такое давление, которое должен создавать реальный газ, чтобы вести себя как идеальный.
по физическому смыслу, фугитивность – это такое давление, которое должен создавать реальный газ, чтобы вести себя как идеальный.
Стандартное состояние должно быть одинаковым, то есть  . В этом случае
. В этом случае  , поэтому
, поэтому  , где
, где 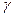 - коэффициент фугитивности:
- коэффициент фугитивности:  (мера не идеальности реального газа).
(мера не идеальности реального газа).
При таком подходе: 

Таким образом, другой физический смысл коэффициента фугитивности заключается в следующем:
Коэффициент фугитивности пропорционален работе, которую необходимо затратить, чтобы перевести один моль газа из реальных в идеальные условия.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 657; Нарушение авторских прав?; Мы поможем в написании вашей работы!