
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Условие фазового равновесия
|
|
|
|
Основные понятия
Фазовое равновесие
- Фаза – часть термодинамической системы, обладающая одинаковыми параметрами во всех своих точках (P,T,состав, природа) и имеющая видимую границу раздела, отделяющую ее от остальной системы.
По числу фаз все системы можно разделить на гомогенные – содержащие одну фазу и гетерогенные – содержащие несколько фаз. Если система содержит несколько фаз одной природы, такая система называется гетерофазной системой.
Любую фазу составляют химические вещества.
- Составляющая системы – индивидуальное вещество, входящее в состав системы, которое может быть выделено из системы простым физическим воздействием и существовать вне системы сколь угодно долго.
С другой стороны, некоторые вещества в системе могут образовываться самостоятельно, поэтому было введено понятие независимая составляющая системы – индивидуальное химическое вещество, наименьшее количество которого необходимо и достаточно для образования всех возможных фаз, имеющихся в системе и находящихся в термодинамическом равновесии.
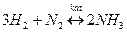
Для характеристики количества независимых параметров вводиться новое понятие – степень свободы. Степень свободы – число независимых параметров, изменение которых в определенных пределах не приводит и фазовым изменениям в системе (старые фазы не исчезают, новые не появляются).
По числу степеней свободы обычно выделяют:
Дивариантную систему С=2
Моновариантную систему С=1
Инвариантную систему С=0
Понятие фазового равновесия подобно понятию термодинамического равновесия и включает в себя несколько составляющих.
- Термодинамическое равновесие:
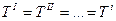
- Механическое равновесие:
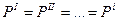
- Химическое равновесие:
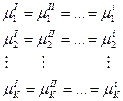
Составление фазового равновесия чаще всего относится к гетерогенным системам, и описывают с помощью правил фаз Гиббса, которые связывают число компонентов, число фаз и число термодинамических степеней свободы.
|
|
|
В общем виде правило фаз Гиббса можно записать как:
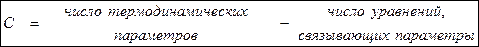
Выведем уравнение Гиббса:
Пусть наша система состоит из Ф фаз, каждая из которых содержит К компонентов. Независимыми термодинамическими параметрами, влияющими на состояние фазового равновесия, являются температура и давление (T, P).
Дополнительными термодинамическими параметрами являются составы каждой из фаз. Для того, чтобы полностью описать состав системы, необходимо знать К-1 состав.
Таким образом, для полного описания состава всей гетерогенной системы необходимо знать (К-1)Ф составов, то есть число термодинамических параметров будет равно: 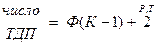
Для вывода числа уравнений, связывающих термодинамические параметры, воспользуемся условием фазового равновесия. Так как давление и температура у нас фиксированы для всей системы в целом, то основными уравнениями, связывающие термодинамические параметры будут являться уравнения для химических потенциалов. Если система содержит Ф фаз, то для описания химического равновесия потребуется Ф-1 уравнение, так как система содержит К компонентов, общее число уравнений будет равно (Ф-1)К.
Таким образом, правило фаз Гиббса можно записать в виде:
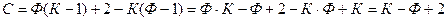
С – число термодинамических степеней свободы.
К – число компонентов, то есть независимых составляющих системы.
Ф – число фаз.
2 – число независимых термодинамических параметров (P и T).
В общем случае, диаграмма состояния гетерогенной системы представляет собой n–мерный график. Однако, в силу сложности получающихся диаграмм, чаще всего используют плоские, фиксируя один из независимых термодинамических параметров. Наиболее распространенными являются диаграммы Температура – Состав и
|
|
|
Давление – Состав.

В этом случае число термодинамических степеней свободы превращается в условное 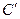 :
:
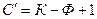
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 2553; Нарушение авторских прав?; Мы поможем в написании вашей работы!