
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Периодическая система элементов (ПСЭ). Закономерности изменения радиуса атомов химических элементов и электроотрицательности в периодах и группах ПСЭ
Периодическая система элементов (ПСЭ).
Основной закон (современная формулировка): Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра и порядкового номера элемента в таблице, Т.к. с ростом заряда ядра и порядкового номера периодически возобновляется электронная конфигурация внешнего слоя, что и приводит к периодическому изменению свойств от Ме к НеМе.
Структура ПСЭ. ПСЭ является графическим отображением периодического закона или даже ряда законов т.к. существует более 500 вариантов таблицы.
Групповые аналоги – элементы одной группы, объединенные по признаку одинакового числа валентных электронов на внешнем слое (пример: 17Cl 3s23p5 и 25Mn 3d54s2).
Электронные аналоги – элементы, объединенные в одну подгруппу и обладающие одинаковым числом и типом валентных электронов (их объединяет структура Э[ ] (n-1)d2ns2 ).
Взаимосвязь химических (физических) свойств с местоположением элемента:
1. Радиус атома (орбитальный) – условная расчетная величина (т.к. атом не имеет четких границ), это радиус условной сферы, в пределах которой сосредоточена основная электронная плотность атома.
В каждом периоде слева направо (т.е. с увеличением  порядкового номера) уменьшается. Монотонное уменьшение нарушается при переходе от одного типа элемента к другому.
порядкового номера) уменьшается. Монотонное уменьшение нарушается при переходе от одного типа элемента к другому.
Монотонность нарушается:
а) при переходе от d к p - R(Zn)<R(Ga)
б) при стремлении к минимуму энергии – R(Ni)<R(Cu).
В периодах с уменьшением R ослабляются Ме свойства и нарастают НеМе.
С ростом заряда ядра (в периодах слева направо) усиливается взаимодействие электронного облака с ядром, что приводит к сжатию электронного облака = уменьшению радиуса - Rа(К)<Rа(Сu).
В главных подгруппах, сверху вниз, при переходе от одного периода к другому, Ra увеличивается за счет увеличения числа электронных слоёв. Чем больше R, тем сильнее Ме св ойства. (в группах сверху вниз)
2. Электроотрицательность — интегральная величина, для характеристики реакционной способности атома, определяет способность атома притягивать к себе электронные пары химической связи в соединениях.
< 2 — металлические свойства.> 2 — неметаллические свойства.» 2 — амфотерные свойства.
Электроотрицательность (Э.О.) – способность атома притягивать или отталкивать электронные пары химической связи. Если Э.О. > 1,5 – металл; 1,5< Э.О.<2 – переходные свойства; Э.О.>2 – неметаллы. По Полингу абсолютная Э.О. определяется как х = (Еион+Еср)/z. На практике используется относительная. Э.О. (χ) возрастает по периоду, в целом имея сложную зависимость.
Направление роста χ: 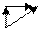
χ ↑ c увеличением степени окисления
χ < 1,5 – металлы;
1,5< χ <2 – амфотерные;
χ >2 – неметаллы.
3. Энергия ионизации (Э.И.) – энергия, необходимая для отрыва электрона и удаления его от атома на бесконечность. В периодах Э.И. возрастает, но не равномерно. В главных подгруппах уменьшается сверху вниз, т.к. радиус увеличивается.
4. Энергия сродства к электрону – энергия, выделяемая или поглощаемая, при присоединении электрона к атому. Свойства аналогичны Э.И.
6. Химическая связь: природа, основные виды и свойства.
Химическая связь – совокупность электростатических сил притяжения и отталкивания, создающих динамически устойчивую систему из двух и более числа атомов.
Минимум энергии: основное условие образования связи 
Атомы большинства химических элементов вступают во взаимодействия и образуют химические связи, стремясь приобрести устойчивую электронную конфигурацию инертных газов путем:
· отдачи и присоединения е- (ионная)
· образование общих е- пар (ковалентная)
· обобществления валентных е- (металлическая)
Основные виды (Основные типы химической связи):
Ковалентная связь – связь атомов за счет образования общей электронной пары с антипараллельными спинами между атомами неметаллов.
Ковалентная неполярная D χ= χ(B)- χ(A)= от 0 до 0.4
Ковалентная полярная D χ= χ(B)- χ(A)= 0,4 – 2
Ионная связь – это связь за счет электростатического взаимодействия противоположно заряженных ионов: катионов (+) и анионов (-). D χ >2 Предельный случай ковалентной. ЭО > 2,2. Образуется два завершённых внеш. уровня.
Водородная связь – связь, обусловленная положительно поляризованным водородом в молекуле и электроотрицательным атомом другой или той же молекулы.
Металлическая связь – связь, обусловленная электростатическим взаимодействием между электронами и положительно заряженными катионами в узлах кристаллической решетки. В узлах решётки — атомы/ионы, между ними — электронный газ.
Свойства (Основные характеристики химической связи):
1. Энергия связи.
Доля энергии расщепления молекулы на свободные газообразные атомы, приходящаяся на одну связь.
Энергия химической связи (Ecв, кДж/моль) – это энергия, которая выделяется при образовании химической связи между 2мя свободными изолированными атомами. Определяет прочность связи.
- энергия разрушения 1 моля газообразного в-ва, отнесенная к 1 молю хим связи.
Ecв = 1/n * ∆Hатомизации, ∆Hатомизации > 0
Ecв = 10 – 1000 кДж/моль
NH3 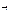 N+ 3H(г) Δ Н 0атомизации= -3 Ехимической связи
N+ 3H(г) Δ Н 0атомизации= -3 Ехимической связи 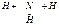
2. Длина. Равновесное расстояние между атомами в молекуле. E» 1/ l. l ДБ < 0,5 нм.
Длина химической связи (Lxc, нм) – средне-равновесное расстояние между ядрами химически связанных атомов.
· l св = 0,1 – 0,3 нм.
· Межмолекулярная = 0,3 – 0,5 нм.
· l св > 0,5 нм - нет взаимодействия.
· Чем Есв ↑, тем l св ↓
 3. Валентный угол.
3. Валентный угол.
Валентный угол – угол между воображаемыми направлениями химических связей.
4. Полярность.
Полярность (из лекц)– образов. Эффективных зарядов на хим связанных атомах в малекуле за счет смещение электронной плотности из – за разной электроотрицательности. H + Cl = HCl; H=+0,018е Cl= -0,018е
Полярность хим связи – смещение электронной плотности к одному из атомов в результате разной электроотрицательности. Полярные молекулы являются диполями.
|
|
Дата добавления: 2013-12-12; Просмотров: 688; Нарушение авторских прав?; Мы поможем в написании вашей работы!