
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение скорости простой и сложной химической реакции. Порядок и молекулярность реакции
Пример
Значение ПР
ПР малорастворимых соединений. Расчет р-римости соли и концентрации ионов по значению ПР.
Малорастворимые и нерастворимые соли ограниченно растворимы, но то, что растворяется, распадается на ионы как сильные электролиты.
Ag3РO4 тв↔3Ag+р-ре + РO43-р-ре
С=const
В растворах малорастворимых солей устанавливается гетерогенное равновесие между твёрдой нерастворимой солью и ионами этой соли в водном р-ре - состояние насыщенного раствора.
Это равновесие характеризуется константой – Произведением Растворимости (ПР)
ПР=Кс=С3(Ag+)*C(РO43-)= const (при T= const)
Произведение растворимости - произведение равновесных концентраций ионов соли в её насыщенном р-ре при данной температуре, возведенных в степень = стехиометрич коэф. (эта величина постоянная, табличная)
Насыщенный р-р – раствор, соединяющий мах возможное кол-во растворенного в-ва, при данной t, находящ в динамичном равновесии с нерастворенной частью в-ва.
ПР характеризует растворимость каждого индивидуального вещества.
По ПР можно рассчитать растворимость вещества и концентрацию ионов соли в насыщенном растворе.
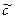 - растворимость (моль/л). Растворимость – предельная С вещества в р-ре, или С насыщенного р-ра.
- растворимость (моль/л). Растворимость – предельная С вещества в р-ре, или С насыщенного р-ра.
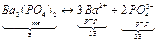 Равновесные концентрации через
Равновесные концентрации через 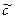
ПР=C3(Ba2+)+C2(PO43-)=(3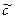 )3•(2
)3•(2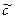 )2=108
)2=108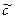 5 ;
5 ; 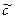 =
=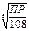 =
=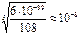 моль/л
моль/л
C(Ba2+)=3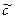 =3•10-8 моль/л; C(PO43-)=2
=3•10-8 моль/л; C(PO43-)=2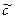 =2•10-8 моль/л
=2•10-8 моль/л
Скорость хим. реакции – скорость изменение концентрации реагентов в единицу времени. Так как в химических реакциях учувствуют несколько компонентов, то скорость химической реакции можно вычислить по любому из этих компонентов.
υАА+υВВ→υсС+υДД
V=1/υАdСА/dτ =1/υД dСд/dτ = +-1/υi dСi/dτ, где С – концентрация, τ – время.
<V> = +- ∆Сi/∆τ
Vисх= +- dСi/dτ = tg α
|
|
Дата добавления: 2013-12-12; Просмотров: 293; Нарушение авторских прав?; Мы поможем в написании вашей работы!