
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диссоциация кислого иона
|
|
|
|
Гидролиз
Na H2PО4 → Na+ + H2PО4-,
H2PО4- + НОН ↔ H3PО4+ OH- Кг = 1,4·10-12.
H2PО4- ↔ HPО42- + Н+ Кд2= 6,2·10-8.
Реакция среды в данном случае будет кислая, так как Кг меньше Кд2(Н3РО4), т.е. процесс диссоциации преобладает над процессом гидролиза.
4 Константа гидролиза
Гидролиз солей в большинстве случаев протекает обратимо. Поэтому для процесса гидролиза, как и любого равновесного процесса, можно записать выражение константы равновесия (Кр).
Пример гидролиза ацетата натрия –
СН3СОО- + Н+ОН- ↔ СН3СООН + ОН-.
Кр = 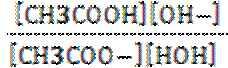
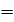
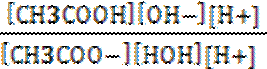 .
.
В полученном выражении концентрацию воды можно перенесли влево, так как в разбавленных водных растворах её исходная и равновесная концентрации практически совпадают. И после умножения числителя и знаменателя отношения на концентрацию ионов водорода, получим в числителе ионное произведение воды, а в знаменателе константу диссоциации уксусной кислоты.
Кг
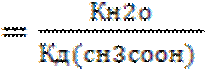 .
.
Поставив в приведенное выражение значение ионного произведения воды 10-14 и константу диссоциации для уксусной кислоты ~10-5 получаем Кг~10-9, т.е. гидролиз протекает незначительно. При переходе к общему выражению
Кг 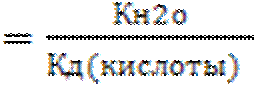
видно, что чем слабее кислота, образующаяся в ходе гидролиза, тем в большей степени протекает гидролиз.
Если соль гидролизуется по катиону, то в общем виде константа гидролиза будет иметь вид
Кг 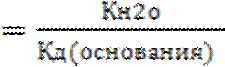 .
.
Из приведенного выражения следует, что чем слабее основание, образующаяся в ходе гидролиза, тем в большей степени протекает гидролиз.
В случае соли гидролизующейся как по катиону так и по аниону выражение константа гидролиза имеет вид
Кг 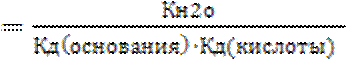 .
.
Так как в знаменатель входит произведение Кд слабых кислот и основания, гидролиз данных солей протекает в большей степени.
|
|
|
5 Смещение равновесия при гидролизе
Гидролиз является равновесным процессом, поэтому для подавления или усиления гидролиза необходимо оказывать внешнее воздействие согласующееся с принципом Ле-Шателье.
5.1 Влияние добавок различных веществ на гидролиз
Рассмотрим этот вопрос на ранее приведенных примерах гидролиза:
1) Если в раствор соли уксусной кислоты, гидролизующейся по аниону
СН3СОО-+ Н+ОН- ↔ СН3СООН + ОН-
добавить щёлочь, т. е. увеличить концентрацию ионов ОН-, то в соответствии с принципом Ле-ІІІателье для уменьшения концентрации ионов ОН- равновесие должно сместится влево, т. е. произойдёт подавление гидролиза.
Если же в этот раствор добавить кислоту, то концентрация ионов ОН- в растворе уменьшится, вследствие связывания гидроксид-ионов ионами водорода. В результате этого воздействия на систему равновесие гидролиза сместится вправо, т.е. произойдёт усиление гидролиза.
Для подавления гидролиза можно добавлять любой раствор, имеющий щелочную реакцию, например раствор соли, гидролизующейся по аниону.
2) В случае соли гидролизующейся по катиону (NH4+)
NH4+ + НОН ↔ NH4OH + Н+
добавление сильной кислоты приводит к увеличению концентрации ионов водорода. Для уменьшения концентрации ионов водорода равновесие гидролиза должно сместиться влево, что приведет к подавлению гидролиза.
Если же в данный раствор добавить щёлочь, то это приведёт к уменьшению концентрации ионов водорода в растворе, из-за связывания их гидроксид-ионами. Вследствие этого равновесие смещается вправо, т.е. гидролиз усилится.
Если соль гидролизуется только по катиону, то гидролиз можно усилить добавлением не только кислоты, но и любого раствора, имеющего кислую реакцию, например, раствора соли, гидролизующейся по катиону.
|
|
|
5.2 Влияние температуры на смещение гидролиза
Гидролиз – это процесс обратный реакции нейтрализации. Поскольку реакция нейтрализации протекает с выделением тепла, т.е. является экзотермической реакцией, то гидролиз – реакция эндотермическая, т.е. протекает с поглощением тепла. Следовательно, для усиления гидролиза нужно повышать температуру раствора и, напротив, для подавления гидролиза температуру следует понижать.
5.3 Влияние концентрации гидролизующейся соли
Гидролиз солей, гидролизующихся только по катиону или только по аниону, зависит от концентрации раствора. Разбавление раствора приводит к усилению гидролиза, а при концентрировании раствора происходит подавление гидролиза.
Гидролиз соли, гидролизующейся одновременно и по катиону и по аниону, можно подавить, уменьшая температуру раствора. Еще более эффективно добавление соответствующих слабых кислот или оснований. Например, гидролиз карбоната аммония можно подавить добавлением NH4OH или СН3СООН. Добавление же щелочей и сильных кислот к раствору соли, образованной катионом слабого основания и анионом слабой кислоты, приведёт к разрушению гидролизующейся соли.
ЛЕКЦИЯ № 8
«ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ»
1 Основные понятия
Окислитель – это элемент или вещество, принимающие электроны (при этом окислитель восстанавливается).
Восстановитель – это элемент или вещество, отдающие электроны (при этом восстановитель окисляется).
Степень окисления – это условный заряд атома в соединении исходя из предположения, что происходит полная ионизация связей.
Расчет степеней окисления (с.о.) элементов в соединении основан на том, что алгебраическая сумма степеней окисления всех элементов равна нулю для молекул или, в случае ионов, его заряду.
В простых веществах связи между атомами неполярные и поэтому с.о. элементов в них равны нулю.
В сложных веществах связи полярные и более электроотрицательные элементы имеют отрицательные с.о., а менее электроотрицательные – положительные с.о. В большинстве соединений с.о. водорода, за исключением гидридов, равна +1, а с.о. кислорода, за исключением пероксидов, равна -2. В пероксидах (Н2О2, Na2O2, BaO2 и др.) с.о. кислорода равна -1. Постоянные степени окисления имеют щелочные металлы +1, щелочноземельные +2, алюминий +3, цинк +2 и некоторые другие.
|
|
|
Примеры расчета с.о. серы в H2SO4 и азота в NO3–:
1) В молекуле H2SO4 сумма с.о. всех элементов равна нулю. Сложив суммы с.о. водорода 2·(+1), неизвестной с.о. серы (обозначим ее х) и с.о. кислорода 4·(–2), получим уравнение
2×(+1) + х + 4×(–2) = 0,
откуда х = +6, т.е. с.о. серы в серной кислоте равна +6.
2) В ионе NO3– сумма с.о. элементов равна заряду иона, т.е. –1 и сложив суммы с.о. кислорода 3×(–2) и с.о. азота (обозначим х), получим уравнение
х+3×(–2) = –1,
откуда х = +5, т.е. с.о. азота в нитрат ионе равна +5.
Степень окисления является важной характеристикой элементов в соединении и необходима для определения окислительно-восстановительных свойств исходных веществ, прогнозирования образующихся продуктов и уравнивания реакций методом электронного баланса.
2 Прогнозирование окислительно–восстановительных свойств веществ по степеням окисления элементов
В простых веществах:
1) Металлы – восстановителями,
2) Неметаллы – окислителями так и восстановителями.
Сложные вещества состоят из атомов с отрицательными и положительными степенями окисления и могут проявлять:
1)В высшей степени окисления – окислительные свойства. Например, азот в НNО3 находится в с.о +5,сера в H2SO4 +6 и т.д.
2) В низшей степени окисления –восстановительные свойства. Например, азот в NН3 находится в с.о -3, сера в H2S -2 и т.д.
3)В промежуточных степенях окисления – окислительные и восстановительные свойства. Например, S+4 в H2SO3 может окисляться до +6 или восстанавливаться до 0 или до -2.
К важнейшим окислителям относятся:
галогены, кислород, пероксиды, некоторые оксиды (PbO2, CrO3), перманганаты (KMnO4), дихроматы (K2Cr2O7), концентрированная азотная кислота и др.
К важнейшим восстановителям относятся:
щелочные и щелочноземельные металлы, цинк, магний, алюминий, железо, водород (Н2), аммиак и др.
3 Основные типы окислительно–восстановительных реакций
Существует три типа окислительно-восстановительных реакции: межмолекулярные, внутримолекулярные и самоокисления–самовосстановления (или диспропорционирования).
|
|
|
Примеры:
1) Межмолекулярные – если окислителем и восстановителем являются элементы, входящие в состав разных соединений.
Na2SO3 + O2 ® Na2SO4;
вос–ль ок–ль
2) Внутримолекулярные– если окислителем и восстановителем являются элементы, входящие в состав одного и того же соединения.
(NH4)2Cr2O7 ® N2 + Cr2O3 + H2O;
в–ль о–ль
3) Самоокисления–самовосстановления – если окислителем и восстановителем является один и тот же элемент, при этом часть его атомов окисляется, а другая – восстанавливается.
H3PO3 ® H3PO4 + PH3.
в–ль/о–ль
4 Составление уравнений окислительно-восстановительных реакций
В настоящее время применяют два основных приёма уравнивания окислительно–восстановительных реакций: метод электронного баланса и ионно–электронный метод. В последующем материале будет применяться метод электронного баланса.
Примеры уравнивания реакций методом электронного баланса:
1) KI + КMnO4 + H2SO4 ® I2 + MnSO4 + K2SO4 + H2O,
I– – восстановитель, окисляется до I2,
Mn+7 – окислитель, восстанавливается до Mn+2,
Составим электронные уравнения:
2I– - 2е = I2 -2 × 5 = -10 е (φ0 = +0,54 В),
Mn+7 + 5е = Mn+2 +5 × 2 = +10 е (φ0 = +1,70 В).
Для равенства количеств отданных и присоединенных электронов, необходимо перед йодом и марганцем в левой и правой части уравнения реакции поставить коэффициенты, соответствующие множителям в электронных уравнениях. Остальные элементы уравнивают методом подбора коэффициентов. По оставшемуся элементу – кислороду проводится проверка материального баланса реакции.
10KI + 2КMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 6K2SO4 + 8H2O.
Для определения возможности протекания данной реакции сравним окислительно-восстановительные потенциалы восстановителя и окислителя. Потенциал окислителя (Mn+7) выше потенциала восстановителя(I–), поэтому прямая реакция протекает самопроизвольно.
2) Сu + НNO3(разб.) → Сu(NO3) 2 + NO + Н2О.
Сu0 – восстановитель, окисляется до Сu+2,
N+5 – окислитель, восстанавливается до N+2.
Составим электронные уравнения:
Сu0 - 2е = Сu+2 × 3 = -6 е (φ0 = +0,34 В),
N+5 + 3е = N+2 × 2 = +6 е (φ0 = +0,96 В).
Поставим в уравнение реакции коэффициенты, соответствующие множителям в электронных уравнениях. Перед азотной кислотой необходимо поставить коэффициент 8, так как две молекулы азотной кислоты являются окислителями, а шесть – расходуются на солеобразование. Для соблюдения материального баланса перед водой необходимо поставить коэффициент восемь.
3Сu + 8НNO3(разб.) = 3Сu(NO3) 2 + 2NO + 4Н2О.
Данная реакция протекает, так как окислительно-восстановительные потенциал окислителя выше потенциала восстановителя.
3) NH4)2Cr2O7 ® N2 + Cr2O3 + H2O.
Восстановитель N-3, окисляется до N2,
окислитель Cr+6 +, восстанавливается до Cr+3 +.
Электронные уравнения:
2N-3 - 6е = N2,
Cr+6 + 6е = 2Cr+3.
Коэффициенты (это 1) в данной реакции ставят в правой части перед окисленной и восстановленной формами, но для соблюдения материального баланса необходимо перед водой поставить коэффициент 4.
(NH4)2Cr2O7 ® N2 + Cr2O3 + 4H2O.
4) H2O2 ® H2O + O2.
Кислород находится в промежуточной с.о. -1, он может повышать степень окисления до 0 и понижать до -2.
Электронные уравнения:
2О-1 - 2е = О2,
О-1 + 1е = О-2.
Коэффициенты ставим в правой части, в данном случае перед окисленной 1и 2 перед восстановленной формами.
2H2O2 ® 2H2O + O2.
5 Взаимодействие металлов с водой, кислотами и щелочами
Важным практическим вопросом для пищевой промышленности является устойчивость металлов в воде и в водных растворах кислот и оснований. Принципиальная возможность протекания данных окислительно-восстановительных реакций определяется положением металлов в электрохимическом ряду.
С водой взаимодействуют металлы от лития до железа включительно. Щелочные и щелочно-земельные металлы энергично вытесняют водород из воды. Железо реагирует при температуре кранного каления (500 0С) с образованием Fе3О4.
Примеры:
1) 2К + 2Н2О = Н2 + 2КОН.
2) 6Fe +8Н2О = 8Н2 + 2Fe3О4.
Ряд активных металлов Аl, Zn, Ве и др. непосредственно с водой не реагируют из-за наличия на их поверхности оксидной пленки.
С соляной и серной (разбавленной) кислотами реагируют все металлы, расположенные в электрохимическом ряду до водорода. В случае образования нерастворимых в воде соединений (PbSО4) реакции практически не протекают. Следует отметить, что железо окисляется до двухвалентного состояния.
Примеры:
1) 2Аl + 3Н2SO4 = 3Н2 + Аl2(SO4)3.
2) Fe +2НСl= Н2 + FeСl2.
С серной концентрированной и азотной кислотами реагируют все металлы за исключнием золота и элементов платиновой группы. В очень концентрированных кислотах многие металлы пассивируются, из-за образования на их поверхности нерастворимых соединений. Железо окисляется до +3, но в очень разбавленной азотной кислоте до +2.
Примеры:
1) 2Fe + 6Н2SO4 = Fe 2(SO4)3+ 3SO2 + 6Н2О.
2) 3Сu + 8НNO3(разб.) = 3Сu(NO3) 2 + 2NO + 4Н2О.
3) Сu + 4НNO3(конц.) = Сu(NO3) 2 + 2NO2 + 2Н2О.
Наиболее вероятные продукты восстановления серной и азотной кислот металлами (в зависимости от концентрации кислоты и положения металла в электрохимическом ряду) приведены в таблице 5.1:
Таблице 5.1 – Продукты взаимодействия металлов с HNO3 и H2SO4
| Кислоты | Положение металла в электрохимическом ряду от Li до Zn от Zn до H от Н до Ag |
| HNO3 разб. | NH4NO3 NO, (N2,N2O) NO |
| HNO3 конц. | N2O (NO), NO2 NO2 |
| H2SO4 разб. | H2, H2S H2 не реагир. |
| H2SO4 конц. | S, (H2S) SO2, S SO2 |
Из приведенной схемы видно, что в случае азотной кислоты, чем активней металл и более разбавлена кислота тем в большей степени происходит восстановление азота.
В водных растворах щелочей растворятся алюминий, цинк и другие амфотерные металлы.
Примеры:
1) 2Аl + 2NаOН + 6Н2О = 2Nа[Аl(ОН)4] + 3Н2,
2) Аl + 2NаOН = 2NаАlО2 + 3Н2.
ТЕМА 4
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
ЛЕКЦИЯ №9
«ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ»
Гальванические элементы – это устройства для превращения энергии химической реакции в электрическую энергию.
В основе работы гальванического элемента лежит явление возникновения электродного потенциала на границе металл – раствор.
1 Электродный потенциал на границе металл – раствор
Металлы – это вещества, в узлах кристаллической решетки которых находятся катионы, а в межатомном пространстве свободные электроны (электронный газ).
При контакте металлов с водой в результате взаимодействия катионов металла (Men+) с дипольными молекулами воды часть ионов металла перейдет в раствор в виде гидратов (Men+·mH2O)
Men+ + mH2O = Men+·mH2O,
а электроны останутся на металле, т.е. раствор будет иметь положительный заряд, а металл — отрицательный. Таким образом, на границе металл/раствор образуется электродный потенциал, который обозначается φ.
Величина электродного потенциала зависит в основном зависит от природы металла и от концентрации соли в растворе электролита.
2 Принцип работы гальванического элемента
Разберем на примере гальванического элемента, составленного из цинкового и медного электродов, опущенных в 1М растворы своих солей. Схема данного элемента приведена на рисунке 1. Цинковый и медный полуэлементы соединены электролитическим мостиком(1). Во внешнюю цепь включен гальванометр(2).
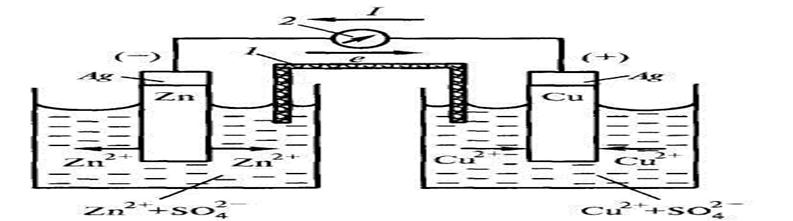
Рисунок 1 Схема гальванического элемента Даниэля-Якоби
Цинковый электрод окисляется легче, чем медный, так как он имеет более отрицательный электродный потенциал. Таким образом цинковый электрод является анодом, а медный – катодом. После перехода электронов с цинкового на медный электрод, электродные потенциалы на обоих электродах нарушаются и для восстановления их значений происходит частичное окисление Zn и восстановление Cu+2.
Накапливающиеся в анодном участке катионы цинка, а в катодном нескомпенсированные сульфат ионы обеспечивают электропроводность внутренней цепи.
На примере элемента Даниеля-Якоби покажем схематическую форму записи гальванического элемента и написание реакций на аноде, катоде и во внутренней цепи.
(А) Zn|ZnSО4 || Cu | CuSО4 (К).
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 532; Нарушение авторских прав?; Мы поможем в написании вашей работы!