
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиз водного раствора сульфата натрия с инертными электродами
|
|
|
|
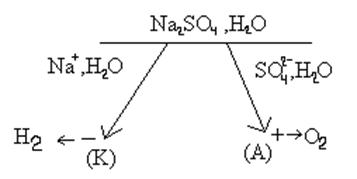
А) 2Н2О - 4e = О2 + 4Н+, К) 2Н2О + 2e = Н2 + 2ОН .
.
Вторичная реакция – Н+ + ОН = Н2О.
= Н2О.
В ходе электролиза идет разложение воды с образованием О2 и Н2. Сульфат натрия не расходуется в ходе электролиза, но он обеспечивает высокую электропроводность электролита.
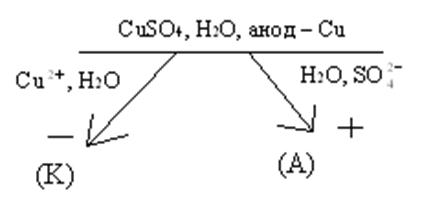
3) Электролиз сульфата меди с медным анодом.
Данный электролиз применяется на практике для электрохимической очистка меди.
К) Сu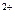 + 2e = Сu
+ 2e = Сu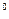 , А) Сu
, А) Сu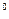 - 2e = Сu
- 2e = Сu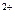 .
.
Из приведенной схемы видно, что в данном случае происходит перенос меди с анода на катод. Два вида примесей, входящих в состав черновой меди, включают в себя неактивные металлы (Аg, Аau, Рt) и активные металлы (Fe, Мn и др.). Неактивные металлы будут образовывать осадок в электролизёре, а в растворе будут накапливаться катионы активных металлов. Поэтому периодически производится замена электролита.
3 Количественные расчёты в электролизе
Так как образование продуктов в ходе электролиза является следствием протекающих реакций, в основе расчетов лежат основные стехиометрические законы.
Применяемые в расчетах законы Фарадея – это частный случай применения закона эквивалентов к электрохимическим реакциям.
Объединенный закон Фарадея имеет вид
m(х) = 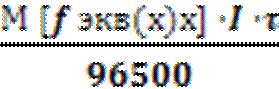
где, m(х) – масса окисленного или восстановленного вещества при электролизе в граммах,
М [f экв(х)х] – молярная масса эквивалента этого вещества,
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1118; Нарушение авторских прав?; Мы поможем в написании вашей работы!