
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение гидридов элементов II-периода
|
|
|
|
ВОДОРОДНАЯ СВЯЗЬ
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
Это связь между катионами металла и электронным «газом».
Благодаря данной связи металлы обладают:
высокими температурами плавления, высокой тепло- и электропроводностью, высокой прочностью, способностью отражать свет, пластичностью, ковкостью и др. свойствами.
Валентные электроны металлов слабо связаны со своими ядрами и могут легко отрываться. В результате этого в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны (электронный газ), электростатическое взаимодействие которых приводит к металлической связи.
Атом водорода, связанный с высоко электроотрицательным элементом (фтором, кислородом, азотом и др.), способен образовывать еще одну химическую связь. Например, водородная связь между молекулами: 1)воды, 2) уксусной кислоты
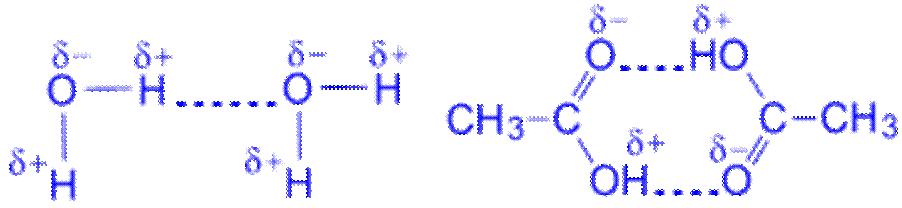
Эта связь значительно слабее других химических связей (энергия ее образования 10–40 кДж/моль.
Исключительно важную роль водородная связь играет в таких неорганических веществах как вода, плавиковая кислота, аммиак и т.д., а также в биологических макромолекулах.
В растворах могут возникать длинные цепи ассоциатов вида:
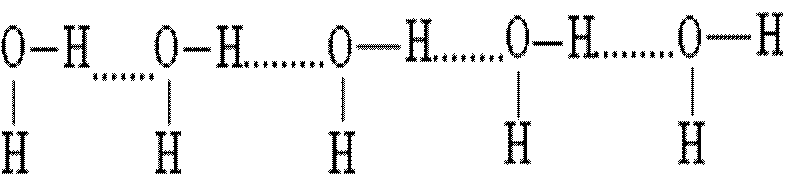
Наличие водородных связей объясняет аномально высокие температуры плавления и кипения воды. Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С.
Водородные связи могут возникать как между различными молекулами, так и внутри молекулы.
Если атом образует несколько связей, с участием различных орбиталей, то может происходить такое явление как гибридизация атомных орбиталей. Гибридизация – это выравнивание формы и энергии различных орбиталей при образовании ковалентной связи.
|
|
|
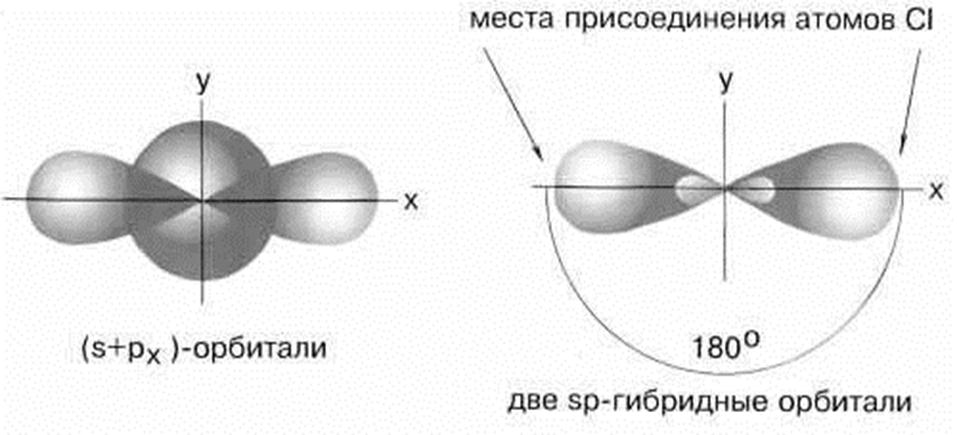 5.1. Строение ВеСl2. sp – гибридизация
5.1. Строение ВеСl2. sp – гибридизация
Рисунок 3. sp – гибридизация
Молекула BeCl2 имеет линейную форму, а обе связи Be–Cl совершенно одинаковы.
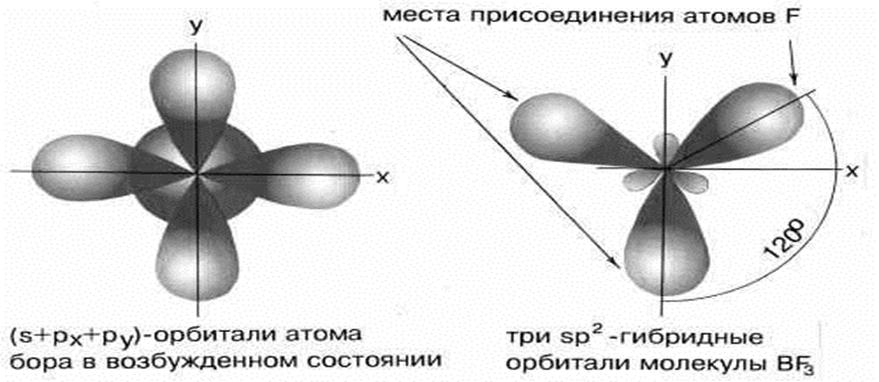
5.2. Строение ВF3. sp2 –гибридизация
5.2. Строение молекулы СН4. sp3 –гибридизация
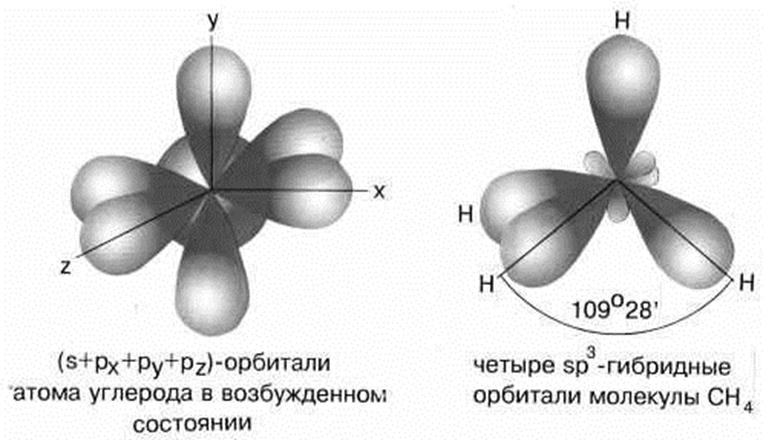
Молекула метана имеет форму правильного тетраэдра, у которого в центре находится атом C, а в вершинах – атомы H. Углы между всеми связями равны и составляют 109°28'.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 447; Нарушение авторских прав?; Мы поможем в написании вашей работы!