
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидроксид аммония - слабое основание
 |
Азот
Электронное строение и общая характеристика
Р-ЭЛЕМЕНТЫ V ГРУППЫ
В главную подгруппу V группы входят элементы: азот (N), фосфор (Р), мышьяк (Аs), сурьма (Sb) и висмут (Вi). На внешнем энергетическом уровне атомов этих элементов находятся по пять электронов. Электронная формула валентной зоны атомов имеет вид – ns2np3, а энергетическая диаграмма соответственно вид, представленный на рис. 1.
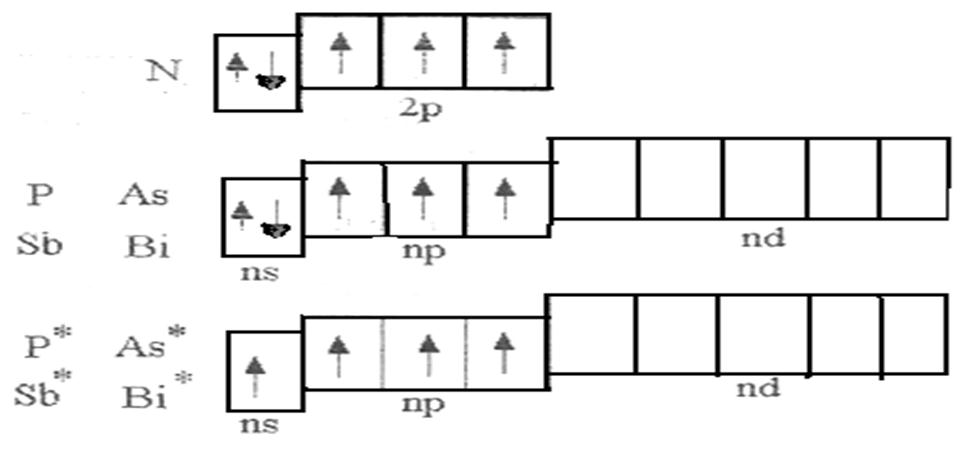
Рисунок 1. Энергетические диаграммы валентных зон р-элементов V группы
Из рисунка 1 видно, что данные элементы могут быть трех и пяти валентны. Максимальная валентность азота равна четырем (три связи могут быть образованы по обменному механизму и одна – по донорно-акцепторному).
Основные степени окисления данных элементов -3, 0, +3 и +5. При этом для азота возможны все степени окисления: -3; -2; -1; 0; +1; +2; +3; +4; +5. Для висмута наиболее устойчивая степень окисления +3, поэтому соединения Вi+5 обладают сильными окислительными свойствами.
В подгруппе с увеличением порядкового номера уменьшаются неметаллические свойства и усиливаются металлические. Сурьма относятся к металлам, так как имеют характерный металлический блеск и присущую металлам электро- и теплопроводность.
Молекулярный азот - газ без цвета и запаха, плохо растворимый в воде. Молекула азота двухатомна (N2). Азот – главная составная часть воздуха (78 % по объёму). В промышленности азот получают ректификацией жидкого воздуха.
Молекулярный азот является практически инертным веществом. При обычной температуре реагирует только с литием. С кислородом начинает реагировать при 3000-4000 0С. Это объясняется большой прочностью молекул N2 за счет трех химических связей между атомами азота. При 3000 0С азот диссоциирует на атомы примерно на 0,1%. Вследствие превращения в природе соединений азота преимущественно в молекулярный азот, происходит обеднение почвы соединениями азота. Эта проблема «связанного азота» была решена посредством синтеза аммиака
|
|
|
N2 + 3Н2 = 2NН3↑.
Аммиак – бесцветный газ с резким запахом. Температура кипения при атмосферном давлении -33,4 °С. Благодаря хорошим теплофизичеким свойствам широко используется в холодильной технике.
Аммиак хорошо растворяется в воде (34% при 20 0С). Водный раствор аммиака называют нашатырным спиртом. Высокая растворимость аммиак является следствием его взаимодействия с водой с образованием гидроксида аммония
NH3 + НОН ↔ NH4OH.
NH4OH ↔ NH4+ + OH-, К = 1,8∙10-5.
Аммиак взаимодействует с кислотами с образованием солей аммония:
1) NH3 + HCl → NH4CI,
2) 2 NH3 + H2SO4 → (NH4)2SO4.
Аммиак образует ряд комплексных соединений – аммиакатов
Пример – СuSО4 + 4NН3 = Сu(NН3)4SО4.
Соли аммония термически неустойчивы и при нагревании они разлагаются, при этом возможны 2 типа разложения:
1) Без изменения степеней окисления
NH4CI → NH3 + HCl.
2) С изменением степеней окисления, как внутримолекулярная окислительно-восстановительная реакция
NH4NO2 → N2↑ + 2 Н2O.
В атмосфере кислорода аммиак горит
4NH3 + 3О2 → 2N2 + 6Н2O.
Для получения азотной кислоты аммиак окисляют в присутствии катализатора до NO
4 NH3 + 5O2 → 4 NO + 6 Н2O.
Из NO окислением получают NО2 и затем азотную кислоту по реакции
4NО2 + O2 + 2H2O → 4НNO3.
Азот образует следующие оксиды:
1) N2О и NO - несолеобразующие оксиды;
2) N2О3 и N2О5 – кислотные оксиды соответственно азотистой и азотной кислот;
3) NО2 – смешанный кислотный оксид азотистой и азотной кислот.
Азотистая кислота НNО2 – слабая кислота
НNО2 ↔ H+ + NO2-, К = 4·10-4.
|
|
|
Азотистая кислота и её соли (нитриты) проявляют окислительно-восстановительную двойственность, так как азота находится в промежуточной степени окисления +3.
Азотная кислота НNО3 является сильной кислотой
НNО3 → H+ + NO3-.
Проявляет высокие окислительные свойства. Не реагирует только с Аu и металлами платиновой группы (за исключением Оs). Более сильными окислительными свойствами обладает смесь НNО3 и НС1(1:3). Данную смесь называют «царской водкой», так как она способна растворять золото
Аu + НNО3 + 4НС1 = Н[АuСl4] + NО + 2Н2О.
Концентрированная НNО3 пассивирует Аl, Fе, Со, Ni, Сr и нержавеющие стали.
Степень восстановления азотной кислоты зависит от активности металла и концентрации кислоты:
Сu + 4 НNО3 (конц.) = Сu(NО3)2 + 2 NO2 + 2 Н2О,
Сu + 8 НNО3 (разб.) = 3 Сu(NО3)2 + 2 NО + 4 Н2О,
4Мg + 10НNО3 (очень разб.) = 4Мg(NО3)2 + NН4NО3 + 3Н2О.
Из приведенных реакций следует, что чем активней металл и более разбавлена азотная кислота тем в большей степени она восстанавливается. При этом водород практически не выделяется.
Соли азотной кислоты – нитраты хорошо растворимы в воде.
Наиболее важное практическое значение имеют нитраты натрия (NаNО3), калия, аммония и кальция, которые называют селитрами. Важна биологическая роль азота, так как он входит в состав белковых молекул.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1740; Нарушение авторских прав?; Мы поможем в написании вашей работы!