
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сравнение свойств водородных соединений р-элементов VI группы
|
|
|
|
Сера
Известны несколько аллотропных модификаций серы: ромбическая сера, моноклинная, пластическая. При нормальных условиях сера - твёрдое жёлтое вещество, нерастворимое в воде, но хорошо растворимое в органических растворителях.
Сера со многими металлами (Zn, Al, Fe, Сu, щелочные и щелочноземельные металлы) взаимодействует непосредственно
2Аl + 3S → Al2S3.
При высокой температуре сера взаимодействует с водородом с образованием сероводорода (H2S) – бесцветный газ с характерным запахом (тухлых яиц)
Н2 + S → Н2S.
Сероводород очень ядовит и способен вызвать тяжёлые отравления.
Сероводородная кислота является слабой двухосновной кислотой
Н2S ↔ H+ + НS-, К1 = 6∙10-8,
НS- ↔ H+ + S-2, К2 = 1∙10-14.
Сероводородная кислота образует соли –сульфиды, характеризующиеся низкой растворимостью
CuSO4 + H2S → CuS↓ + H2SO4,
Cu2+ + SO42- + H2S → CuS↓ + 2H+ + SO42-,
Cu2+ + H2S → CuS↓ + 2H+.
Протекание этой реакции возможно потому, что произведение растворимости образующегося сульфида меди меньше общей константы диссоциации сероводородной кислоты:
ПP(CuS) = 6∙10-36 << Кобщая(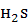 )=К1∙ К2 =6∙10-22.
)=К1∙ К2 =6∙10-22.
При поджигании на воздухе сероводород горит голубоватым пламенем
2 H2S + 3 O2 → 2 SO2 + 2 Н2O (в избытке кислорода).
Оксид серы (IV) образуется при горении серы на воздухе. Он хорошо растворяется в воде с образованием сернистой кислоты
SO2 + Н2O ↔ H2SO3.
Сернистая кислота – слабая двухосновная кислота (К1=1,6∙10-2, К2=6∙10-8). Её соли являются хорошими восстановителями и окисляются до серной кислоты или сульфатов
2 H2SO3 + O2 → 2 H2SO4.
При высокой температуре в присутствии катализатора (V2O5, сплавы на основе платины) диоксид серы окисляется кислородом до триоксида, который в свою очередь используется для получения серной кислоты:
|
|
|
2SO2 + O2 → 2SO3,
SO3 + Н2O → Н2SО4.
Концентрированная серная кислота, особенно горячая, - энергичный окислитель. Она восстанавливается до SO2, S или Н2S. Чем более активен металл, тем более глубоко восстанавливается кислота.
Сu + 2 Н2SO4 (конц.) → СиSO4 + SO2↑ + 2 Н2O;
3 Zn + 4 Н2SO4(конц.) → 3 ZnSО4 + S↓ + 4 Н2O.
Н2SO4 - сильная двухосновная кислота. В разбавленных водных растворах она диссоциирует практически полностью по схеме:
Н2SO4 → 2 Н+ + SO42-.
Олеум - это раствор SO3 в концентрированной серной кислоте.
В ряду Н2O – Н2S − Н2Sе − Н2Те с увеличением молекулярных масс должно наблюдаться повышение температур кипения. Как видно из рисунка 3 данная зависимость соблюдается, за исключением Н2О. Установлено, что аномальное повышение температуры кипения Н2О является следствием образования водородных связей между отдельными молекулами воды.
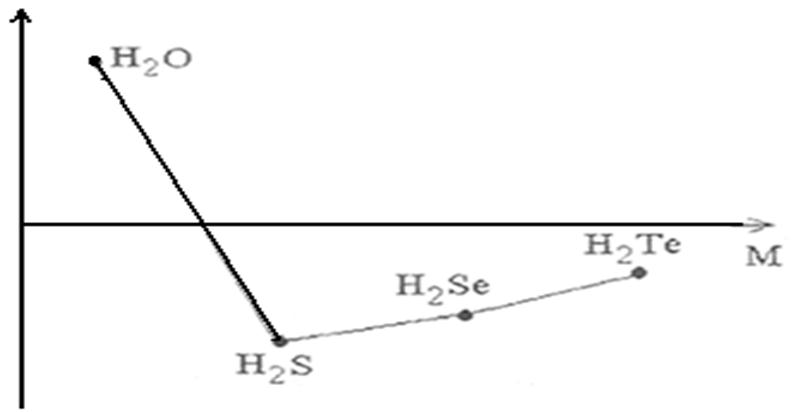
Рисунок 3 – зависимость температуры кипения водородных соединений р-элементов VI группы от молекулярной массы
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 481; Нарушение авторских прав?; Мы поможем в написании вашей работы!