
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комплексный ион в свою очередь диссоциирует по типу слабого электролита, то есть обратимо и ступенчато
|
|
|
|
[Fe(CN)6]-3 ↔ Fe+3+6CN-.
Для комплексных ионов допускается запись в одном уравнении продуктов диссоциации по всем ступеням.
Продукты диссоциации комплексного иона:
1) комплексообразователь – Fe3+,
2) лиганды – 6СN -.
Таким образом, в состав комплексного соединения входят: комплексообразователь, лиганды и частицы нейтрализующие заряд комплексного иона.
Типичные комплексообразователи – катионы металлов побочных подгрупп: Ag+, Cu2+, Fe3+ и другие.
Типичные лиганды: галогенид-ионы, CN-, NO2- , NH3, H2O и другие.
Комплексообразователь посредством ковалентных связей и(или) электростатического взаимодействия образует прочную связь с лигандами.
Координационным числом – число монодентатных лигандов, координированных вокруг комплексообразователя. Кординационное число, как правило, равно удвоенному заряду комплексообразователя
Число связей, образуемых каждым лигандом с центральным атомом, называют дентатностью лиганда. Например, монодентатные лиганды – F–, Br–, I–, CN–, OH–, NH3, H2O, бидентатные лиганды – H2N–CH2–CH2–NH2 – этилендиамин, оксалат-, карбонат-ионы и другие. Примером полидентатных лигандов может служить этилендиаминтетраацетат-ион (ЭДТА):
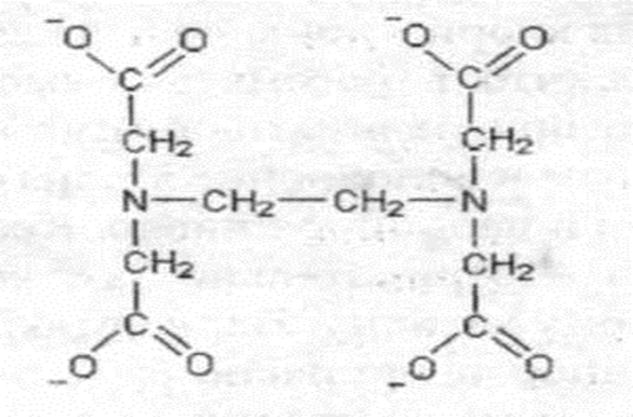
Комплексы с полидентатными лигандами называются хелатными. Многие хелатные комплексы широко распространены в природе и играют важную роль в биологических процессах, например, гемоглобин крови (комплексообразователь Fe2+), хлорофилл (комплексообразователь Mg2+).
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 451; Нарушение авторских прав?; Мы поможем в написании вашей работы!