
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квадратные скобки указывают на молярную концентрацию
|
|
|
|
Примеры состава комплексных соединений
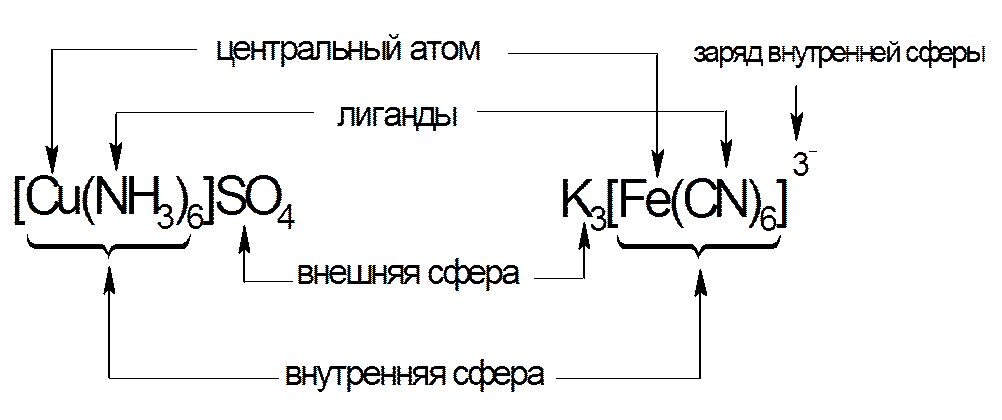
3. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Название комплексного соединения состоит из двух слов, состоящих из названий аниона и катиона. Название читается справа налево, при этом анион называют в именительном падеже, а катион – в родительном.
Названии комплексного иона (или электронейтральной комплексной частицы) включают число лигандов и их название. Число лигандов указывают греческими числительными:
1 – моно, 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта, 8 – окта.
Названия наиболее распространённых лигандов: F– – фторо-; Cl– – хлоро-; Br– – бромо-; I– – йодо; OH– – гидроксо-; SO32– – сульфито-; NO2– – нитро-; CN– – циано-; NCS– – родано-, NH3–аммин-; en- – этилендиамин-, H2O – аква-.
Название комплексообразователя зависит от заряда иона в который он входит. В случае комплексного катиона или комплексной частицы без внешней сферы применяется русское название комплексообразователя, а в случае комплексного аниона – после названия лигандов добавляется корень латинского названия элемента-комплексообразователя и окончание «-ат».
Если в состав внутренней сферы комплекса входят в качестве лигандов молекулы и анионы, то в первую очередь называют анионы (с окончанием на «о»), а затем молекулы. Если для комплексообразователя возможно несколько степеней окисления, то ее указывают в круглых скобках римской цифрой.
Примеры названий комплексных соединений анионного типа:
Na[Al(OH)4] – тетрагидроксоалюминат натрия
K3[Fe(CN)6] – гексацианоферрат (III) калия
K4[Fe(CN)6] – гексацианоферрат (II) калия
K2[Pt(NH3)2Cl4] – тетрахлородиамминплатинат (II) калия
Примеры названий комплексных соединений катионного типа:
[Ag(NH3)2]Cl – хлорид диамминсеребра
[Pt(NH3)4Cl2]Cl2 –хлорид дихлоротетраамминплатины (IV)
[Cu(H2O)4]SO4 – сульфат тетрааквамеди (II)
Примеры названий электронейтральных комплексов:
[Cr(H2O)3F3] – трифторотриаквахром
[Co(NH3)3(NO2)2Cl] – хлородинитротриамминкобальт
[Pt(NH3)4Br2] – дибромотетраамминплатина
4. ДИССОЦИАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Как отмечалось ранее, комплексные соединения диссоциирует по типу сильного электролита на комплексоообразователь и ионы внешней сферы. В свою очередь комплексный ион или электронейтральный комплекс диссоциируют по типу слабого электролита на коплексообразаватель и лиганды.
Пример диссоциации анионного комплекса – гексацианоферрат(II) калия
K4[Fe(CN)6] → 4K+ + [Fe(CN)6]-4,
[Fe(CN)6]-4 ↔ Fe+2 + 6CN-.
Так как диссоциация комплексного иона является обратимым процессом, то количественно состояние равновесия характеризуется соответствующим значением Кр. Применительно к диссоциации комплексного иона вместо Кр записывают Кн – константа нестойкости 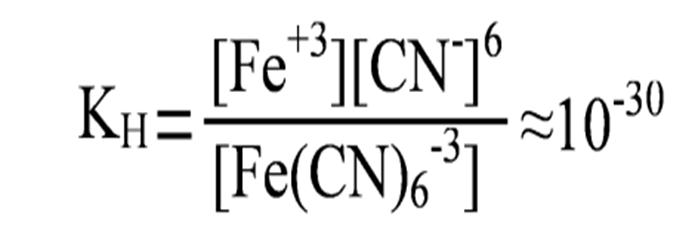 .
.
Пример диссоциации катионного комплекса – сульфата тетрааминмеди(II)
[Cu(NH3)4]SO4 → [Cu(NH3)4]+2 + SO4-2,
[Cu(NH3)4]+2 ↔ Cu+2 + 4NH3,
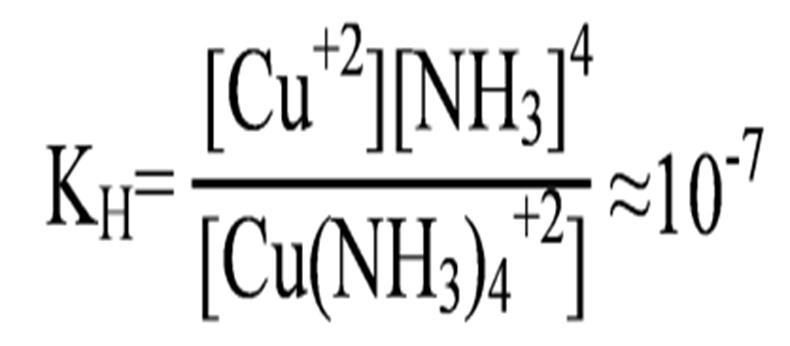 .
.
5. РЕАКЦИИ С УЧАСТИЕМ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
5.1. Образование комплексных соединений
Примеры реакций образования комплексных соединений:
1) Ni(NO3)2 + 6NH3 → [Ni(NH3)6](NO3)2,
Ni2+ + 2NO3- + 6NH3 → [Ni(NH3)6]2+ + 2NO3 -,
Ni2+ + 6NH3 → [Ni(NH3)6]2+;
2) Cr(OH)3 + 3KOHконц. →
Cr(OH)3 + 3KOHконц. ↔ K3[Cr(OH)6],
Cr(OH)3 + 3К+ + 3OH– ↔ [Cr(OH)6]3 – + 3К+ ,
Cr(OH)3 + 3OH– ↔ [Cr(OH)6]3–.
Вывод:
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1981; Нарушение авторских прав?; Мы поможем в написании вашей работы!