
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Донорно-акцепторное взаимодействие молекул. Полимеры и комплексы
|
|
|
|
Х-Н... Y,
гд е Х, Y -атомы F, О, N, Cl, S.
Энергия и длина водородной связи определяется электрическим моментом диполя связи Х-Н и размерами атома Y. Длина водородной связи уменьшается, а энергия возрастает с увеличением разности электроотрицательностей атомов Х и Y (и соответственно электрического момента диполя связи Х-Н) и с уменьшением размера атома Y.
Рассмотрим возникновение водородной связи при взаимодействии молекул Н2О и гидрате аммиака.
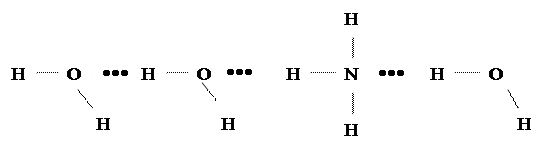 В молекуле Н2О общая электронная пара смещена к более электроотрицательному атому кислорода вследствие чего атом водорода поляризуется положительно, а атом кислорода отрицательно. В жидкой воде и кристалле льда образуются водородные связи.
В молекуле Н2О общая электронная пара смещена к более электроотрицательному атому кислорода вследствие чего атом водорода поляризуется положительно, а атом кислорода отрицательно. В жидкой воде и кристалле льда образуются водородные связи.
Важную роль водородная связь играет в процессах кристаллизации и растворения веществ, а также при образовании кристаллогидратов.
Аномалии воды, которые будут рассмотрены в последующих разделах связаны с образованием водородной связи.
Рассмотренный выше механизм образования ковалентной связи называется обменным. Если образование ковалентной связи происходит при взаимодействии одного атома или иона с заполненной атомной орбиталью с другим атомом или ионом имеющим свободную орбиталь, то такой механизм образования ковалентной связи называется донорно-акцепторным.
При наличии у атомов одной молекулы свободной орбитали, а у атомов другой молекулы электронной пары, между этими молекулами возникает взаимодействие по донорно-акцепторному механизму.
Донорно-акцепторное взаимодействие возможно как между одинаковыми молекулами, так и между разными.
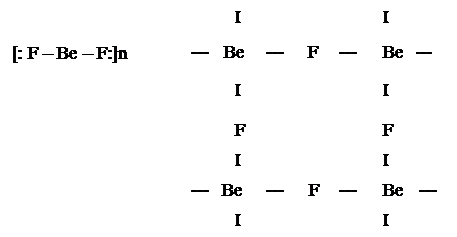 В первом случае образуются полимерные молекулы (ВеF2)n. В молекуле ВеF2 атомы бериллия имеют свободные орбитали и являются акцепторами, а атомы F имеют неподеленные электронные пары и могут быть донорами. Между молекулами ВеF2 донорно-акцепторное взаимодействие с образованием полимера.
В первом случае образуются полимерные молекулы (ВеF2)n. В молекуле ВеF2 атомы бериллия имеют свободные орбитали и являются акцепторами, а атомы F имеют неподеленные электронные пары и могут быть донорами. Между молекулами ВеF2 донорно-акцепторное взаимодействие с образованием полимера.
|
|
|
Донорно-акцепторное взаимодействие между разными молекулами приводит к образованию сложных соединений, называемых комплексами. Рассмотрим на примере образования хлорида метиламмония. Атом азота в молекуле имеет неподеленную электронную пару и играет роль донора, атом водорода в НСl свободную орбиталь и выполняет роль акцептора.
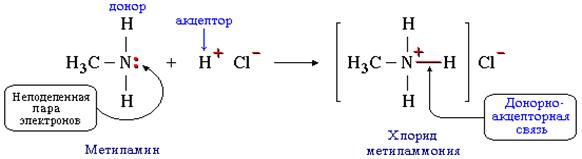
Энергия межмолекулярного донорно-акцепторного взаимодействия изменяется от значений, характерных для сил Ван-дер-Ваальса, до значений, соответствующих энергии химической связи.
1.5. Строение кристаллов. Химическая связь в твердых телах ………….
1.5.1. Кристаллическая решетка. Характеристики
кристаллической решетки……………………………………………………….
1.5.2. Классификация кристаллов. Типы кристаллов:
молекулярные, ковалентные, ионные и металлические.
Металлическая связь ……………………………………………………………..
1.5.3. Зонная теория кристаллов……………………………………………….
1.5.4. Реальные кристаллы……………………………………………………..
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 768; Нарушение авторских прав?; Мы поможем в написании вашей работы!