
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основания
|
|
|
|
КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
Кристаллы со смешанными связями
Существует большая группа твердых веществ, в кристаллах которых имеют место разные по типу связи. Например, в молоекулярных кристаллах типа H2O, NH3 одновременно с силами Ван-дер-Ваальса действуют силы водородной связи, следствием чего является относительное повышение прочности этих твердых веществ, а также температур их плавления. Поэтому при оценке свойств такого кристаллического тела нужно вводить поправки.
Возникновение дополнительных видов связей в ковалентных кристаллах может привести к резкому изменению их основных характеристик. Наглядным примером кристаллов со смешанными связями является графит – одна из форм углерода (рис.1.18).
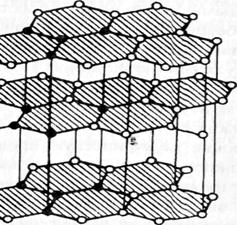
Рис. 1.18.
Атомы углерода в графите связаны друг с другом так, что образуют плоские двухмерные слои, где они связаны друг с другом за счет sp2-гu6puдных орбиталей. У которых валентные углы связей равны 120°, а длина связи С—С в плоскости равна 0,142 нм. В этом слое у каждого атома имется один нелокализованный электрон, участвующий в образовнии p - связи. Электропроводность графита – следствие переноса тока этими электронами.
Двухмерные слои связаны друг с другом слабыми силами Ван-дер-Ваальса. Кристалл графита в направлении этой оси имеет низкую прочность и является изолятором. Таким образом графит является ковалентным кристаллом в одном направлении и молекулярным в другом. Четвертый валентный электрон (р - электрон) каждого атома вступает в p -связь с соседними
атомами.
Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ.
|
|
|
Сложные вещества (или химические соединения). Молекулы состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.
| Неорганические вещества | |
| Простые | Металлы |
| Неметаллы | |
| Сложные | Оксиды |
| Основания | |
| Кислоты | |
| Соли |
Резкой границы между металлами и неметаллами нет, т.к. есть простые вещества, проявляющие двойственные свойства.
Аллотропия
Аллотропия - способность некоторых химических элементов образовывать несколько простых веществ, различающихся по строению и свойствам.
С - алмаз, графит, карбин.
O - кислород, озон.
S - ромбическая, моноклинная, пластическая.
P - белый, красный, чёрный.
Явление аллотропии вызывается двумя причинами:
1) различным числом атомов в молекуле, например кислород O2 и озон O3
2) образованием различных кристаллических форм, например алмаз и графит.
Основания - сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами (с точки зрения теории электролитической диссоциации, основания - сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид - анионы OH-).
Классификация. Растворимые в воде (щёлочи) и нерастворимые. Амфотерные основания проявляют также свойства слабых кислот.
Получение
1. Реакции активных металлов (щелочных и щелочноземельных металлов) с водой:
2Na + 2H2O =2NaOH + H2
Ca + 2H2O = Ca(OH) 2 + H2
2. Взаимодействие оксидов активных металлов с водой:
BaO + H2O =Ba(OH)2
3. Электролиз водных растворов солей
2NaCl + 2H2O = 2NaOH + H2 + Cl2
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 290; Нарушение авторских прав?; Мы поможем в написании вашей работы!