
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрохимическая поляризация
|
|
|
|
Химическая поляризация
Концентрационная поляризация
Изменение потенциала электрода вследствие изменения концентрации реагентов в приэлектродном слое при прохождении тока называется концентрационной поляризацией.
Изменение концентрации реагирующих веществ в приэлектродном слое связано с замедленностью подвода реагентов к электроду и отвода продуктов реакции от него.
Концентрационная поляризация уменьшается при увеличении коэффициента диффузии, а также при уменьшении толщины приэлектродного слоя. Это достигается с помощью конвекции (перемешивания) раствора.
Поляризация называется химической, когда она вызываеся изменением химического состояния электрода. Рассмотрим на примере элемента Вольта.
(А) Zn | H2SO4 | Сu (К)
Zn - 2e = Zn2+ 2H+ + 2e = H2
Потенциал положительного электрода уменьшаеся, т.к. насыщение водородом приводит к образованию ” водородного электрода “, потенциал которого меньше, чем у металлического.
Изменение потенциала электрода, обусловленное замедленностью собственно электрохимической стадии процесса, называется электрохимической поляризацией или перенапряжением.
Электрохимическая реакция протекает лишь тогда, когда реагирующие частицы обладают энергией большей, чем энергия активации.
Как и химическая реакция, электрохимическая реакция протекает лишь тогда, когда реагирующие частицы обладают энергией большей, чем энергия активации.
Скорость электрохимической реакции, как и химической, увеличивается с повышением температуры, а также при использовании катализаторов. С увеличением температуры растет доля активных молекул. В случае применения катализатора понижается энергия активации, т.е. опять же увеличивается доля активных молекул.
|
|
|
Энергия активации электрохимической реакции может быть также снижена при изменении потенциала электрода по сравнению с его равновесным потенциалом, т.е. при поляризации. А так как при уменьшении Еа увеличивается скорость реакции, то увеличение поляризации приводит к ускорению электрохимической реакции, т.е. повышению плотности тока. И чем больше энергия активации процесса, т.е., чем медленнее процесс протекает в прямом и обратном направлениях при равновесии, тем большая поляризация требуется для обеспечения определенной скорости электрохимического процесса, выражаемой через плотность тока.
Поляризацию можно уменьшить, если увеличить площадь электрода, т.к. плотность тока уменьшается с увеличением площади электрода.
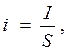
где i – плотность тока; I – величина тока; S – площадь электрода.
Поляризация при выделении металлов не велико, а при выделении водорода и кислорода очень высокое.
Есть и положительная сторона этого процесса, благодаря перенапряжению при выделении водорода можно выделить такие металлы, как никель, цинк и др., потенциал которых становится более высоким чем у водородного.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 2335; Нарушение авторских прав?; Мы поможем в написании вашей работы!