
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения ксенона
|
|
|
|
При взаимодействии ксенона с фтором в зависимости от условий опыта получается либо дифторид ксенона XeF2, либо тетрафторид ХеF4, либо гексафторид ХeF6. При нормальной температуре все это — твердые вещества белого цвета. В химическом отношении наиболее активен гексафторид ксенона ХеF6. Он легко взаимодействует с кремнеземом:
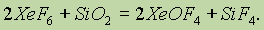
Образующийся при этом окситетрафторид ксенона XeOF4 при нормальной температуре — летучая бесцветная жидкость.
Все фториды ксенона взаимодействуют с водой. При этом в реакции с дифторидом и тетрафторидом образуется ксенон, кислород и фтороводород:
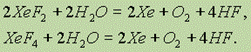
Однако при взаимодействии с водой гексафторида получается новое соединение — оксид ксенона (VI):
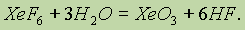
Оксид ксенона (VI) ХеО3 — это бесцветное кристаллическое вещество, которое в твердом состоянии весьма взрывоопасно (по силе взрыва оно не уступает тринитротолуолу). В растворе же оксид ксенона (VI) устойчив и безопасен, фториды ксенона — сильные окислители. При взаимодействии с водородом они восстанавливаются до ксенона. Поэтому реакция:
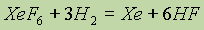
служит для получения чистого ксенона.
Фториды ксенона проявляют окислительныесвойства и по отношению к другим веществам, например:
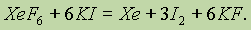
Вслед за фторидами ксенона удалось получить и фторид радона. Однако вследствие сильной радиоактивности радона это соединение мало изучено. Получены и фториды криптона KrF2 и KrF4, которые также оказались значительно менее устойчивыми, чем соответствующие соединения ксенона. Соединения же неона, аргона и гелия не получены.
Из кислородных соединений, помимо оксида ксенона (VI) ХеО3, получены оксид ксенона (VIII) ХеО4, а также соответствующие им кислоты — Н6ХеО6 и Н4ХеО6. Хотя сами эти кислоты неустойчивы, их соли — ксенаты (например, Na4XeO6, Ва3ХеО6) и перксенаты (например Nа6ХеО6, Ba2XeO6) — при комнатной температуре представляют собой достаточно устойчивые кристаллические вещества.
|
|
|
Получены также соли криптоновой кислоты — криптат бария ВаКrО4 и др. Таким образом, благородные газы способны вступать в реакции и образовывать соединения с обычными ковалентными связями.
Вместе с тем уже известны и химические соединения благородных газов с ионной связью. Их удалось получить, используя для отрыва электронов от их атомов гексафторид платины PtF6 — газ темно-красного цвета, являющийся даже более сильным окислителем, чем фтор. Уравнение реакции взаимодействия ксенона с гексафторидом платины можно представить так:
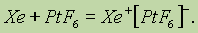
Образовавшийся гексафторплатинат ксенона — твердое оранжевое вещество, имеющее ионную кристаллическую решетку.
Химия инертных элементов — это достижение науки последних десятилетий.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 2587; Нарушение авторских прав?; Мы поможем в написании вашей работы!