
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хром образует три оксида: СrО, Сr2O3 и СrO3
Оксид хрома (II) СrО — пирофорный черный порошок (пирофорность — способность в тонкораздробленном состоянии воспламенятьсяна воздухе). Получается окислением амальгамы хрома кислородом воздуха. Растворяется в разбавленной соляной кислоте:
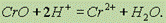
На воздухе при нагревании выше 100° С оксид хрома (II) превращается в оксид хрома (III).
Соли хрома (II). По своим химическим свойствам соли Cr2+ похожи на соли Fe2+. Обрабатывая их растворы щелочами в отсутствие кислорода, можно получить желтый осадок гидроксида хрома (II):

который обладает типичными основными свойствами. Является восстановителем. При прокаливании Cr(OH)2 в отсутствие кислорода образуется оксид хрома (II) СrО. При прокаливании на воздухе превращается в Сr2О3.
Все соединения хрома (II) довольно неустойчивы и легко окисляются кислородом воздуха в соединения хрома (III):
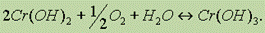
Соли хрома (III). Соли трехвалентного хрома сходны с солями алюминия по составу, строению кристаллической решетки и растворимости. В водных растворах катион Сr3+ встречается только в виде гидратированного иона [Сr(H2O)6]3+, который придает раствору фиолетовый цвет (для простоты пишут Сr3+).
При действии щелочей на соли хрома (Ш) выпадает студнеобразный осадок гидроксида хрома (III) — Сr(ОН)3 зеленого цвета:
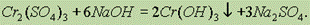
Гидроксид хрома (III) обладает амфотерными свойствами, растворяясь как в кислотах с образованием солей хрома (III):
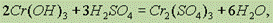
так и в щелочах с образованием тетрагидроксихромитов, т. е. солей, в которых Сг3+ входит в состав аниона:
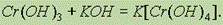
В результате прокаливания Сr(ОН)3 можно получить оксид хрома (III) Сr2О3:
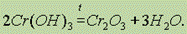
Оксид хрома (III) Сr2O3 — тугоплавкий порошок зеленого цвета. По твердости близок к корунду, поэтому его вводят в состав полирующих средств. Получается соединением элементов при высокой температуре.
Сr2О3 представляет собой зеленые кристаллы, практически нерастворимые в воде. Сr2О3 может быть также получен при прокаливании дихроматов калия и аммония:

При сплавлении Cr2O3 со щелочами, содой и кислыми солями получаются соединения Сг3+, растворимые в воде:
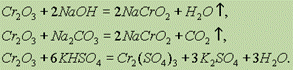
Оксид хрома (VI) — кислотный оксид, ангидрид хромовой H2CrO4 и дихромовойH2Cr2O7 кислот.
Получается при взаимодействии концентрированной серной кислоты с насыщенным раствором дихромата натрия или калия:
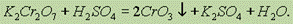
СrО3 имеет кислотный характер: легко растворяется в воде, образуя хромовые кислоты. С избытком воды образует хромовую кислоту H2CrO4:
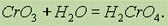
При большой концентрации СrО3 образуется дихромовая кислота H2Cr2O7:
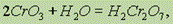
которая при разбавлении переходит в хромовую кислоту:
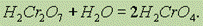
Хромовые кислоты существуют только в водном растворе. Однако, их соли весьма устойчивы.
СrО3 представляет собой ярко-красные кристаллы, легко растворимые в воде.Сильный окислитель: окисляет иод, серу, фосфор, уголь, превращаясь при этом в Cr2O3. Например:
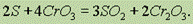
При нагревании до 250° С разлагается:
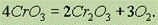
Он реагируетсо щелочами, образуя желтые хроматы СrO42- :

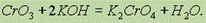
В кислой среде ион СrO42- превращается в ион Сr2O72- .
В щелочной среде эта реакция протекает в обратном направлении:
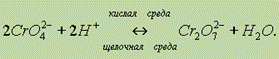
В кислой среде дихромат-ион восстанавливается до Сr3+:
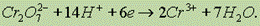
Если сопоставить гидроксиды хрома с разной степенью окисления
Сr2+(ОН)2, Сr3+(ОН)3 и Н2Сr6+O4, то легко сделать вывод, что с возрастанием степени окисления основные свойства гидроксидов ослабевают, а кислотные усиливаются.
Сr(ОН)2 проявляет основные свойства, Сr(ОН)3 — амфотерные, а H2CrO4 — кислотные.
Хроматы и дихроматы (VI). Наиболее важными соединениями хрома в высшей степени окисления 6+ являются хромат (VI) калия К2СrО4 и дихромат (VI) калия K2Cr2O7.
Хромовые кислоты образуют два ряда солей: хроматы —так называются соли хромовой кислоты, и дихроматы — так называются соли дихромовой кислоты. Хроматы окрашены в желтый цвет (цвет хромат-иона СrO42-), дихроматы — в оранжевый (цвет дихромат-иона Сr2O72-).
Дихроматы Na2Cr2O7× 2Н2O и K2Cr2O7 называются хромпиками. Они как окислители применяются в кожевенной (дубление кож), лакокрасочной, спичечной и текстильной промышленности. Хромовая смесь — так называется 3%-ный раствор дихромата калия в концентрированной серной кислоте — применяется в химических лабораториях для мытья стеклянной посуды.
Соли хромовых кислот в кислой среде — сильные окислители:
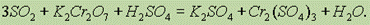
Соединения хрома (III) в щелочной среде играют роль восстановителей. Под действием различных окислителей — Cl2, Br2, H2O2, КмnO4 и др. — они переходят в соединения хрома (IV) — хроматы:

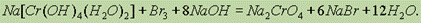
Здесь соединение Cr (III) изображено в форме Na[Cr(OH)4(H2O)2],так как в виде ионов Na+ и [Cr(OH)4(H2O)2]- оно существует в избытке раствора щелочи.
Сильные окислители, такие, как KMnO4, (NH4)2S2O8 в кислойсреде переводят соединения Cr (III) в дихроматы:
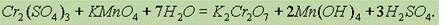
Таким образом, окислительные свойства последовательно усиливаются с изменением степеней окисления в ряду: Cr2+ ® Cr3+ ® Cr6+. Соединения Cr (II) — сильные восстановители, легко окисляются, превращаясь в соединения крома. (III). Соединения хрома (VI) — сильные окислители, легко восстанавливаются в соединения хрома (III). Соединения с промежуточной степенью окисления, т. е. соединения хрома (III), могут при взаимодействии с сильными восстановителями проявлять окислительные свойства, переходя в соединения хрома (II), а при взаимодействии с сильными окислителями (например, бромом, KMnO4) проявлять восстановительные свойства, превращаясь в соединения хрома (VI).
Соли хрома (III) весьма разнообразны по окраске: фиолетовые, синие, зеленые, коричневые, оранжевые, красные и черные. Все хромовые кислоты и их соли, а также оксид хрома (VI) ядовиты: поражают кожу, дыхательные пути, вызывают воспаление глаз, поэтому, работая с ними, необходимо соблюдать все меры предосторожности.
|
Дата добавления: 2013-12-12; Просмотров: 2622; Нарушение авторских прав?; Мы поможем в написании вашей работы!