
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электроотрицательность элементов
 |
Классификация химических связей
Глава 3. Химическая связь
Вопросы для самопроверки
1. Что такое преобразование суждения?
2. Чем отличается обращение суждения от превращения суждения?
3. Каким принципам подчиняется истинность (ложность) суждения?
4. Какую функцию выполняет таблица истинности (ложности) суждения?
Упражнения
Преобразуйте суждения, используя правила превращения, обращения и противопоставление предикату.
1) Некоторые студенты неуспевающие. 2) Все лесные делянки зачищены. 3) Ни одна буровая не простаивала в этом году. 4) Среди студентов есть спортсмены. 5) Трудности его не страшат.
Пример: Все металлы – электропроводны. Ни один металл не является неэлектропроводным; (превращение).
Все студенты – учащиеся. Некоторые учащиеся – студенты; (обращение).
Все студенты – учащиеся. Некоторые учащиеся – не являются студентами; (противопоставление предикату).
Одним из наиболее важных вопросов химии является вопрос химической связи, требующий объяснения причин и выявления закономерностей образования связей между атомами, ионами, молекулами на основе теории строения атома и периодического закона Д.И.Менделеева, а также характеристики этих связей посредством интерпретации физических и химических свойств веществ. В настоящее время для изучения химической связи в основном используют два метода:
1) валентных связей;
2) молекулярных орбиталей.
В рамках первого метода рассматривают индивидуальные атомы, вступающие во взаимодействие, исходя из принципа завершенности электронной оболочки (правило октета). Ковалентная связь с точки зрения метода валентных связей образуется за счет обобществления электронной пары.
Простой метод валентных связей для химика наиболее понятен, удобен и нагляден, лучше всего отвечает целям первичного обучения. Недостаток метода валентных связей состоит в том, что в его рамках нельзя объяснить некоторые экспериментальные данные.
Большей эффективностью обладает метод молекулярных орбиталей, в котором рассматриваются электроны, находящиеся в поле притяжения, созданном всеми атомными ядрами молекулы. С точки зрения метода молекулярных орбиталей в молекуле нет атомов как таковых, а есть взаимно отталкивающиеся ядра и взаимодействующие с ними и между собой электроны. Метод молекулярных орбиталей позволяет полнее объяснить экспериментальные данные.
При характеристике химической связи обычно пользуются такими понятиями, как «валентность», «степень окисления» и «кратность связи».
Валентность – способность атома химического элемента к образованию связи с другими атомами. За величину валентности принимают для ионных соединений количество отданных или принятых электронов. Для ковалентных соединений валентность равна числу обобществленных электронных пар.
Степень окисления – это условный заряд, который был бы на атоме в том случае, когда все полярные ковалентные связи были бы ионными.
Кратность связи между данными атомами равна числу их обобществленных электронных пар.
Все связи, рассматриваемые в химии, можно разделить на связи, приводящие к образованию новых веществ, и межмолекулярные связи.
Связи, приводящие к образованию новых веществ, возникают в результате спаривания электронов. Спаренные электроны находятся в поле притяжения всех ядер молекул. Такое перераспределение электронной плотности дает выигрыш в энергии в сравнении с несвязанными атомами. Именно наличием этого выигрыша и обусловлено образование химической связи. В зависимости от способа перераспределения электронов выделяют связи ковалентные, ионные и металлические. По наличию или отсутствию поляризации ковалентные связи делят на полярные – между атомами разных элементов – и неполярные – между атомами одного элемента. По способу образования ковалентные связи разделяют на обычные, донорно-акцепторные и дативные.
|
|
|
|
|
|
Характеристику связи между атомами можно давать на основе электроотрицательности.
Электроотрицательность – способность атома, связанного с другим атомом, притягивать к себе электронное облако, вызывая тем самым поляризацию связи. Используют различные количественные оценки электроотрицательности атома, например полусумму его сродства к электрону и потенциала ионизации (метод Малликена) (табл. 3.1).
Таблица 3.1
Относительные электроотрицательности атомов в виде
полусуммы сродства к электрону и потенциала ионизации
| Период | Группы элементов | |||||||
| I | II | III | IV | V | VI | VII | VIII | |
| Н 2,1 | He | |||||||
| Li 0,97 | Be 1,47 | B 2,01 | C 2,50 | N 3,07 | O 3,50 | F 4,10 | Ne | |
| Na 1,01 | Mg 1,23 | Al 1,47 | Si 1,47 | P 2,1 | S 2,6 | Cl 2,83 | Ar | |
| K 0,91 | Ca 1,04 | Sc 1,20 | Ti 1,32 | V 1,45 | Cr 1,56 | Mn 1,60 | Fe 1,64 Co 1,70 Ni 1,75 | |
| Cu 1,75 Rb 0,89 | Zn 1,66 Sr 0,99 | Ga 1,82 | Ge 2,02 | As 2,20 | Se 2,48 | Br 2,74 | Kr |
Существуют и другие подходы к определению электроотрицательности. Так, первой и наиболее известной является шкала Л.Полинга, полученная из термохимических данных и предложенная в 1932 г. За начало отсчета в этой шкале произвольно принята величина электроотрицательности наиболее электроотрицательного элемента фтора, 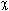 (F) = 4,0 (табл. 3.2).
(F) = 4,0 (табл. 3.2).
Таблица 3.2
Электроотрицательности атомов
в стабильных степенях окисления по Полингу
| Период | Группы элементов | |||||||
| I | II | III | IV | V | VI | VII | VIII | |
| Н 2,1 | He | |||||||
| Li 1,0 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | O 3,5 | F 4,0 | Ne | |
| Na 0,9 | Mg 1,2 | Al 1,5 | Si 1,8 | P 2,1 | S 2,5 | Cl 3,0 | Ar | |
| K 0,8 | Ca 1,0 | Sc 1,3 | Ti 1,5 | V 1,6 | Cr 1,6 | Mn 1,5 | Fe 1,8 Co 1,8 Ni 1,8 | |
| Cu 1,9 Rb 0,8 | Zn 1,6 Sr 1,0 | Ga 1,6 | Ge 1,8 | As 2,0 | Se 2,4 | Br 2,8 | Kr |
Электроотрицательность элементов периодической системы, как правило, последовательно возрастает слева направо в каждом периоде. В пределах каждой группы, за несколькими исключениями, электроотрицательность последовательно убывает сверху вниз. С помощью электроотрицательностей можно охарактеризовать химическую связь. Чем больше разница электроотрицательностей атомов, образующих химическую связь, тем больше степень ионности этой связи. Связи при разности электроотрицательностей атомов больше 2,1 могут считаться чисто ионными (по данным других научных источников, 50%-й ионности связи соответствует разность электроотрицательностей атомов, равная 1,7).
Связи с меньшей разностью электроотрицательностей атомов относят к полярным ковалентным связям. Чем меньше разность электроотрицательностей атомов, образующих химическую связь, тем меньше степень ионности этой связи. Нулевая разность электроотрицательностей атомов указывает на отсутствие ионного характера у образованной ими связи, т. е. на ее сугубую ковалентность.
Электроотрицательность атома, по-видимому, зависит и от степени его окисления. Так, для трех оксидов хрома: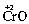 ,
, 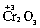 ,
, 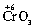 – наблюдается изменение их характера от основного (CrO) через амфотерный (Сr2O3) до кислотного (СrO3). Один и тот же элемент – хром – в СrO ведет себя как типичный металл, в Сr2O3 – как амфотерный металл, а в СrO3 – как типичный неметалл.
– наблюдается изменение их характера от основного (CrO) через амфотерный (Сr2O3) до кислотного (СrO3). Один и тот же элемент – хром – в СrO ведет себя как типичный металл, в Сr2O3 – как амфотерный металл, а в СrO3 – как типичный неметалл.
При составлении химических формул соединений следует учитывать, что более электроотрицательные элементы помещаются правее, например, H2S, OF2, SCl2O, Br3N, SiBr2F2.
|
|
|
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 1629; Нарушение авторских прав?; Мы поможем в написании вашей работы!