
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение вещества. Чудеса святителя Спиридона», сайт «Та
|
|
|
|
Содержание
Минск 2006
ВВЕДЕНИЕ
Кафедра Экологии
БЕЛОРУССКИЙ НАЦИОНАЛЬНЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Чудеса святителя Спиридона», сайт «Татьянин день». Режим доступа: http://www.taday.ru/text/40023.html.
В КУРС ЛАБОРАТОРНЫХ РАБОТ ПО РАДИАЦИОННОЙ
БЕЗОПАСНОСТИ
Составил: инж. В.А.Календо
| Стр. | |
| 1. Строение вещества……………………………….…………………. | |
| 2. Виды ядерных распадов…………………………………………….. | |
| 2.1. Альфа-распад………………………………………………….. | |
| 2.2. Бета-распад……………………………………………….……. | |
| 3. Законы радиоактивности……………………………………………. | |
| 4. Взаимодействие ядерных излучений с веществом………………… | |
| 5. Биологическое воздействие ионизирующего излучения…………. | |
| 6. Радиационный фон………………………………………………….. | |
| 7. Количественные характеристики радиоактивности………………. | |
| 8. Детекторы (счетчики) ионизирующих излучений………………… | |
| 8.1. Полупроводниковый детектор……………………………….. | |
| 8.2. Сцинтилляционный детектор………………………………… | |
| 8.3. Газоразрядный детектор………………………………………. | |
| 8.4. Ионизационная камера……………………………………….. | |
| 9. Приборы для регистрации ядерных излучений……………………. | |
| Контрольный вопросы………………………………………………… | |
| Список литературы……………………………………………………... |
Все вещества в природе состоят из молекул. Молекула - мельчайшая частица вещества, обладающая всеми его химическими свойствами. Все молекулы состоят из атомов химических элементов. Атом – мельчайшая частица химического элемента, обладающая всеми его свойствами. Все химические элементы (> 100) расположены в определенных местах периодической таблицы Менделеева. Место под номером один в периодической системе химических элементов отведено водороду (Н).
|
|
|
Рассмотрим модель строения атома и его ядра для водорода в "нормальных" условиях.
Атом водорода представляет собой сферу, поверхностью которой является электрон (e). В центре сферы находится ядро, в котором сосредоточена почти вся (более 99,95%) масса атома. Резко выраженной границы атом и ядро не имеют.

Рис. 1. Модель атома 
Электрон обладает элементарным отрицательным электрическим зарядом (1,6021892 * 10 -19 Кл). Так как атом электрически нейтрален, то ядро обладает таким же, как электрон, но положительным зарядом. Для любого химического элемента заряд ядра будет:
Q= | e | Z (1)
где: | e | - элементарный электрический заряд;
Z - порядковый номер химического элемента в таблице Менделеева.
Таким образом, порядковый номер химического элемента в таблице Менделеева определяется числом положительных элементарных зарядов в ядре или числом электронов на оболочках нейтрального атома.
Носителем положительного заряда ядра является протон (р) с массой
m=1,6726*10-27 кг
Следовательно, ядро Н состоит из одного протона.
У других химических элементов ядро состоит из протонов и нейтронов. Нейтрон (n) - частица, не имеющая электрического заряда и обладающая массой, примерно равной массе протона. Силы притяжения, связывающие протоны и нейтроны в атомном ядре, называются ядерными силами. Другое название этого явления - сильное взаимодействие.
Протон и нейтрон по способности к сильному взаимодействию не отличаются друг от друга, поэтому в ядерной физике их рассматривают как единую частицу- нуклон - в двух различных состояниях. Нуклоны в состоянии без электрического заряда называется нейтроном, нуклон в состоянии с электрическим зарядом называется протоном.
|
|
|
Число протонов в ядре равно порядковому номеру элемента в периодической системе Менделеева и обозначается знаком Z. Число нейтронов в ядре обозначается знаком N. Общее число протонов и нейтронов в ядре обозначается знаком А и называется массовым числом.
А = Z + N (2)
Ядра с одинаковым числом протонов, но различным числом нейтронов являются ядрами различных изотопов одного и того же химического элемента. Из-за различного числа нейтронов, ядра различных изотопов одного химического элемента обладают разными массами и могут отличаться по физическим свойствам, например по способности к радиоактивному распаду. Из-за одинакового заряда ядра, атомы различных изотопов одного химического элемента имеют одинаковое строение электронных оболочек и поэтому обладают одинаковыми химическими свойствами.
Обозначается изотоп символом химического элемента (Х) с указанием слева вверху массового числа А и слева внизу числа протонов Z в атомном ядре: 
Например, самый легкий изотоп водорода, ядро которого состоит из одного протона, обозначается символом 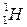 . Тяжелый изотоп водорода - дейтерий, ядро которого содержит один протон и один нейтрон, обозначается символом
. Тяжелый изотоп водорода - дейтерий, ядро которого содержит один протон и один нейтрон, обозначается символом 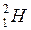 .
.
Конкретное ядро с данными А и Z иногда называют нуклидом.
В настоящее время известно от Z = 1 до Z = 109 и около 2000 изотопов.
Не всякое атомное ядро, состоящее из протонов и нейтронов, может существовать неограниченно долго. Многие из них способны к самопроизвольным превращениям в другие атомные ядра. Устойчивыми являются лишь те атомные ядра, которые обладают минимальным запасом полной энергии среди всех ядер, в которые данное ядро могло бы самопроизвольно превратиться. Из ~ 2000 изотопов только ~ 300 устойчивы.
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 238; Нарушение авторских прав?; Мы поможем в написании вашей работы!