
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зависимость скорости реакции от температуры. В) Последовательно-параллельные реакции
В) Последовательно-параллельные реакции. Один и тот же продукт может получаться по разным цепочкам промежуточных реакций, например
|

 В
В
|
 А Р
А Р
Это механизм, лежащий в основе явления катализа. Промежуточное вещество В может быть соединением реагента А с некоторым веществом, при участии которого реакция значительно ускоряется. Тогда это вещество называется катализатором.
|

 АК
АК
|
 А, К Р, К
А, К Р, К
Каталитическая реакция идет по двум путям, но большая доля продукта образуется при участии катализатора. Однако катализатор не препятствует параллельному протеканию реакции без его участия.
г) Фотохимические реакции. Фотохимические реакции идут при поглощении квантов света определенной энергии (частоты). Необычайно важен фотосинтез, снабжающий калорийной пищей все живое. Без фотосинтеза жизнь в высших формахсуществовать не могла бы.
Основной кинетической характеристикой фотохимических реакций является квантовый выход Ф – отношение числа превращенных частиц к числу поглощенных квантов. Квантовый выход может быть значительно меньше единицы. Это значит, что возбужденная молекула переходит в исходное состояние без химического превращения. Квантовый выход может во много раз превышать единицу, если возникает цепная реакция. Такие реакции, как например взаимодействие водорода с хлором, называются фотокаталитическими, так как квант света лишь инициирует реакцию, не давая дополнительной энергии образующемуся продукту.
В фотохимической реакции
СО2 + h n = CO + O
квантовый выход Ф = 1. Длина волны поглощаемого излучения от 160 до 120 нм.
Скорость фотохимических реакций зависит также от мощности поглощаемого излучения.
Почти все типы реакций, за исключением ферментативных, ускоряются при повышении температуры. Это чрезвычайно важный фактор. Химики постоянно прибегают к нагреванию, используя разнообразные устройства. Попутно отметим, что изменение температуры применяется также для смещения равновесия. Иногда бывает необходимо замедлить нежелательные реакции. В таких случаях применяют холодильники.
Приближенно зависимость скорости реакции от температуры выражается известным правилом Вант-Гоффа. Скорость большинства химических реакций увеличивается в 2 – 4 раза при повышении температуры на каждые 10 градусов.
Скорость реакций при повышении температуры возрастает вследствие увеличения константы скорости, так как концентрации от температуры зависят незначительно. Поэтому далее мы будем рассматривать зависимость константы скорости от температуры. Это экспоненциальная зависимость. Кривая на графике k = f(T) круто уходит вверх:

Аналитически зависимость выражается уравнением

Такую зависимость теперь принято записыватьв виде
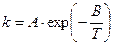
В логарифмических координатах ln k – 1/ T зависимость выражажается прямой линией

Шведский физико-химик С. Аррениус (1889) объяснил сущность темспературной зависимости k тем, что реагирующие частицы для превращения должны обладать некоторым минимальным запасом энергии, без которой превращение сталкивающихся частиц не происходит. При низкой температуре таких частиц мало, и реакция идет медленно, при повышении температуры доля активных частиц возрастает, и реакция ускоряется. Распределением частиц по энергиям от самых низких до высоких значений объясняется тот факт, что химическая реакция идет не только при высоких, но и при низких температурах.
Необходимый избыток энергии частиц, относительно средней энергии, называется энергией активации.
Постоянная B в уравнении Аррениуса представляет собой отношение энергии активации к газовой постоянной R:
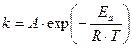
Таким образом, постоянную А можно понять как величину, пропорциональную общему числу столкновений частиц в единицу времени, а экспоненту – как долю активных столкновений.
Рассмотрим на основе уравнения Аррениуса реакцию образования иодоводорода. Для осуществления химического превращения молекулы водорода и иода должны столкнуться.
Из рисунка видно (см. ниже), что в случае, когда частицы обладают достаточным запасом энергии (кривая а), то они, сталкиваясь, переходят в неустойчивое состояние, называемое переходным состоянием. Происходит перераспределение связей между атомами и образование молекулы продукта реакции. При отсутствии достаточного запаса энергии (кривая б) превращение не происходит. Отталкивание между электронными облаками молекул вызывает упругий отскок молекул прежде, чем могло бы произойти перераспределение связей. Возрастание потенциальной энергии, показанное на графике, происходит за счет переходакинетической энергии частиц в потенциальную в момент соударения.
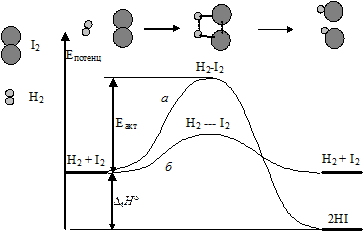
Энергия активации химической реакции зависит от механизма разрыва и образования связей. Она оказывается меньше в согласованном процессе, когда постепенный разрыв имевшихся связей сопровождается постепенным образованием новых.
Теория Аррениуса в дальнейшем развивалась, и в настоящее время имеются детально разработанные теории: теория абсолютных скоростей реакций и теория активированного комплекса.
3. Катализ.
Увеличение скоростей реакций дополнительно вводимыми в систему веществами, называемое катализом, представляет собой специфическое химическое явление, так как в его основе находятся химические реакции между реагентами и катализаторами. Применение катализаторов часто оказывается более действенным и менее рискованным фактором, чем повышение температуры. Роль катализа не только в ускорении реакции, но и в целенаправленном получении заданных продуктов из множества возможных.
Катализатор, участвуя в реакции, открывает для нее путь, по которому процесс идет значительно быстрее. Каталитические реакции относятся к последовательно-параллельным. Их скорость зависит от констант по каталитическому и не каталитическому пути и от концентрации катализатора. В лабораторной работе, которую вы будете проводить, концентрация катализатора берется настолько малой, что оба слагаемых в кинетическом уравнении приблизительно одинаковы. Но это не означает, что катализатор как таковой не эффективен.

Механизм действия катализатора заключается в том, что при его участии для реагентов открывается новый путь превращения, на котором энергии активации понижены по сравнению с некаталитическим путем.
Две основные разновидности катализа – гетерогенный и гомогенный. При гомогенном катализе реагенты и катализатор находятся в одной фазе. При гетерогенном катализе катализатор представляет собой твердое вещество, на поверхности которого идет реакция с газообразными или растворенными реагентами. По химической природе катализаторы могут принадлежать к любым классам веществ – кислотам, основаниям, оксидам, солям, металлам. Самый обширный класс катализаторов составляют белки, которые в качестве катализаторов называются ферментами или энзимами. (Энзим (гр.), фермент (лат.) – в переводе – закваска.) Реагенты в ферментативном катализе принято называть субстратами.
Рассмотрим подробнее типичный механизм ферментативного катализа, описываемый уравнением Михаэлиса-Ментен. Эти исследователи обнаружили, что скорость ферментативной реакции сначала увеличивается по 1-му порядку относительно субстрата S, но при дальнейшем увеличении с (S) выходит на постоянное значение v макс.
Ферментативная реакция состоит из двух стадий – субстрат и фермент сначала образуют так называемый фермент-субстратный комплекс, в котором происходит преобразование молекулы субстрата. Далее комплекс распадается на молекулу продукта реакции и молекулу фермента, которая снова участвует в реакции с субстратом:
| |||
| |||
|

 S + E S×××E P + E
S + E S×××E P + E
Напишем кинетические уравнения для образования конечного продукта и фермент-субстратного комплекса:
v =  = k2c (S×××E) (1)
= k2c (S×××E) (1)
 = k1c (S) c (E) - k-1c (S×××E) - k2c (S×××E) (2)
= k1c (S) c (E) - k-1c (S×××E) - k2c (S×××E) (2)
Общая (начальная) концентрация фермента всегда много меньше концентрации субстрата, так как фермент высокомолекулярное вещество. Концентрация свободного фермента
c (E) = co (E) - c (S×××E) (3)
В стационарном состоянии  = 0; тогда
= 0; тогда
k1c (S) c (E) - k-1c (S×××E) - k2c (S×××E) = 0 (4)
Подставляем выражение (3) в (4)
k1 c(S)[ co (E) - c (S×××E)] - k-1c (S×××E) - k2c (S×××E) = 0 (5)
В уравнении (5) раскрываем квадратные скобки и преобразуем для нахождения концентрации фермент-субстратного комплекса S×××E:
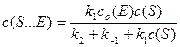
Делением числителя и знаменателя на k 1, получаем
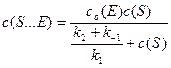 (6)
(6)
Выражение в знаменателе 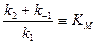 называется константа Михаэлиса.
называется константа Михаэлиса.
Подставляем полученное выражение в ур. 1:
 (7)
(7)
Например, при разложении перекиси водорода каталазой k 2 = 1,25×105 с-1; KМ = 0,025 моль/л.
При большой концентрации субстрата (c (S)>> KМ) константой KМ пренебрегаем, и тогда c (S) сокращается:
v макс = k 2 c o(E)
Максимальная скорость зависит от концентрации фермента и не зависит от концентрации субстрата. Это означает, что реакция идет по нулевому порядоку относительно субстрата.
При малой концентрации субстрата (c (S)<< KМ) реакция имеет первый порядок:
v =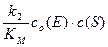
Таким образом, при увеличении концентрации субстрата порядок реакции изменяется от первого (область I на рис.) до нулевого (область III).
|

На примере кинетики ферментативных реакций мы видим, какими необычными могут оказаться кинетические уравнения для сложных химических реакций.
|
|
Дата добавления: 2013-12-13; Просмотров: 460; Нарушение авторских прав?; Мы поможем в написании вашей работы!