
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Протолитические реакции
 |
Классификация кислот
В общем виде кислоту как донор протона обозначают символом НВ. Кислота может не иметь заряда (моле-кулярная кислота), но может быть как катионом так и анионом. Основание как акцептор протона обозначается символом:В или просто В. Наличие свободной электронной пары у основания обязательно. В таблице приведены примеры кислот с разными зарядами. В качестве примеров оснований можно взять те же частицы, лишенные одного протона. В скобках в таблице даны вещества, в состав которых входят электрически заряженные кислоты и основания. Все эти вещества относятся к классу солей. Для катионной частицы в качестве противоиона чаще всего берут Cl–, а для анионной – Na+. Можно брать и другие анионы сильных кислот и катионы сильных оснований.
| Молекулярные | Катионные | Анионные | |
| Кислоты | HCl, HF, H2SO4, CH3COOH, C2H5OH | NH4+ (NH4Cl), RNH3+ (RNH3Cl) | HSO4– (NaHSO4), H2PO4– (NaH2PO4) |
| Основания | NH3, RNH2 | NH2CH2CH2NH3+ (NH2CH2CH2NH3Cl) | OH– (NaOH), O2– (Na2O), NH2– (NaNH2), C2H5O– (C2H5ONa), Cl– (NaCl), F– (NaF), CH3COO– (NaCH3COO), HSO4– (NaHSO4), |
| Амфолиты | RCH(NH2)COOH, Zn(OH)2, белки, H2O | Al(OH)2+ (Al(OH)Cl2) | HCO3– (NaHCO3) |
Если вещество может (в зависимости от свойств второго реагента) как отдавать, так и связывать протон, то оно называется амфолитом. Амфолитами являются некоторые гидроксиды металлов, кислые и основные соли, аминокислоты, белки. Протонные растворители (в том числе вода) также амфолиты.
Различают разновидности кислот по природе атома, с которым связан протон:
ОН-кислоты – самые многочисленные. Это кислоты, образующиеся при соединении оксидов неметаллов с водой, органические карбоновые кислоты и др.
Галоген-Н кислоты – практически важны, но не многочисленны, так как галогены одновалентны. Есть галоген-Н кислоты среди комплексных соединений.
|
|
|
SH-кислоты – слабые (Н2S, RSH). Имеют важное биологическое значение. Такой кислотой является ацетил-кофермент-α. Кислотами являются также селеноводород и теллуроводород.
СН, NH-кислоты – слабые, возникают при сильном мезомерном эффекте. Как примеры можно назвать трифенилметан, циановодород и пиррол.
Центральным понятием протолитической теории является протолитическая реакция. Это реакция переноса протона от кислоты к основанию. Первоначально было предложено так называть перенос протона от молекулы кислоты к молекуле растворителя. Прочие реакции переноса протона называли прототропными. В последнее время протолитическими называют любые реакции переноса протона.
После потери протона оставшаяся часть молекулы кислоты становится основанием. Вместе они составляют сопряженную кислотно-основную пару. Такие пары частиц записывают в виде дроби: HCl/Cl–, H2SO4/HSO4–, NH4+/NH3.
 | |||||
| |||||
 | |||||

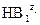
 +
+ 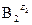 =
=  +
+ 
| |||
| |||
Куда смещено равновесие? Вправо, если кислота 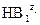 сильнее, чем
сильнее, чем  . Можно говорить и о силе основания: равновесие смещено вправо, если основание
. Можно говорить и о силе основания: равновесие смещено вправо, если основание 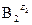 сильнее, чем
сильнее, чем  .
.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 3791; Нарушение авторских прав?; Мы поможем в написании вашей работы!