
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворение малорастворимого электролита выражается уравнением в общем виде
|
|
|
|
Согласно данным таблицы, незначительная растворимость сульфата кальция объясняется значительным уменьшением энтропии. Это связано с сильной гидратацией двухзарядных ионов. В случае однозарядных ионов хлорида натрия гидратация ионов относительно слаба, и энтропия увеличивается за счет перехода ионов из упорядоченного состояния в кристаллах в хаотическое состояние в растворе.
Термодинамика растворения
Рассмотрим термодинамику гетерогенного процесса лишь на двух примерах
А(кр) = А(aq)
| Вещество | D Н °, кДж | D S ° Дж/К | D G ° кДж | s, моль/л |
| CaSO4 | –20 | –145 | +23,2 | 0,015 |
| NaCl | +3,9 | –9,0 | 5,1 |
 KnAm(кр) nKm+(aq) + mAn–(aq)
KnAm(кр) nKm+(aq) + mAn–(aq)
Состояние равновесия характеризуется константой

Осадок, с =1 (концентрация не в фазе раствора, а в фазе осадка)
Константы растворимости приводятся в справочниках.

При смешивании растворов, содержащих по отдельности ионы, образующие нерастворимое вещество, возникает пересыщенный раствор и образуется осадок.
Вместо осадка иногда образзуется коллоидный раствор.
Осадок образуется при П с > Ks
Осадок растворяется при П с < Ks
Состояние равновесия (насыщенный раствор) при П с = Ks
Выведем уравнения, связывающие растворимость и константы растворимости для электролитов разного ионного состава.
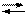 СаС2О4 Са2+ + С2О42-
СаС2О4 Са2+ + С2О42-
с о 1 0 0
 = s 1 s s
= s 1 s s
с (Са2+)× с (С2О42-) = Ks
Ks = 2,3×10-9
s 2= Ks 
s, моль/л 4,8×10-5
М = 128
s, мг/л 4,8×10-5´ 128 ´1000 = 6,1
 CaF2 Са2+ + 2F-
CaF2 Са2+ + 2F-
с о 1 0 0
 = s 1 s 2 s
= s 1 s 2 s
с (Са2+)× с 2(F–) = K s
Ks =4×10-11
4 s 3 = K s 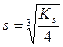
s, моль/л 2,15×10-4
М = 78
s, мг/л 2,15×10-4´ 78 ´1000 = 16,8
В случае соли KnAm общая формула для расчета растворимости
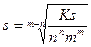
Наиболее распространенные типы солей KA, K2A, KA2
Растворимость однотипных солей можно сравнивать непосредственно по константам растворимости. У солей разных типов такое сравнение не корректно. В рассмотренных примерах фторид кальция трехионная соль, а оксалат кальция двухионная. У них Ks (CaF2) < Ks (CaC2O4), но s (CaF2) > s (CaC2O4). Это объясняется с наличием в уравнении ЗДМ для фторида кальция квадрата малой концентрации фторид-иона.
|
|
|
У гидроксиапатита Са5(РО4)3ОН Ks =1,6×10-58, s = 0,054 мг/л. Очевидно, что растворимость этой соли уменьшается с повышением рН среды, так как с(ОН–) = Kw /c(H+), а равновесие
 Са5(РО4)3ОН(кр) 5Ca2+ + 3PO42– + ОН–
Са5(РО4)3ОН(кр) 5Ca2+ + 3PO42– + ОН–
смещается влево при увеличении с (ОН–).
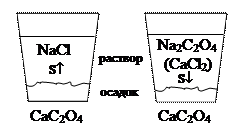
Растворимость малорастворимых солей изменяется в присутствии растворимых солей. Следует рассматривать влияние двух типов таких солей: 1) соли с одноименными ионами и 2) соли без одноименных ионов.
Одноименными ионами принято называть одинаковые ионы в составе двух или нескольких солей. Например, по отношению к оксалату кальция СаС2О4 солями с одноименными ионами были бы различные соли кальция и различные оксалаты. Рассмотрим растворимость СаС2О4 в растворе оксалата натрия Na2C2O4. Эта соль резко увеличит концентрацию оксалат-ионов, что приведет к смещению равновесия
 СаС2О4 Са2+ + С2О42–
СаС2О4 Са2+ + С2О42–
влево. Концентрация ионов кальция уменьшится. Следовательно, уменьшится и растворимость. Выведем зависимость растворимости от концентрации Na2C2O4.
 СаС2О4 Са2+ + С2О42–
СаС2О4 Са2+ + С2О42–
со 1 0 с(Na2C2O4)
 = s´ 1 s´ s´+с(Na2C2O4)
= s´ 1 s´ s´+с(Na2C2O4)
По закону действующих масс
s ´(s ´+ c)= Ks
Считая, что концентрация растворимой соли c >> s ´, пренебрежем значением s ´ в скобках, и получим формулу
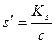
Пусть с = 0,1 моль/л тогда s´= 2,3×10–9/0,1= 2,3×10–8 моль/л; s/s´= 2000. Можно рассчитать, во сколько раз понизилась растворимость оксалата кальция по сравнению с его растворимостью в чистой воде:
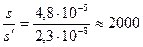
Растворимость уменьшилась более, чем в 2 тысячи раз.
Любая соль, не содержащая одноименных ионов, будет создавать повышенную ионную силу среды, снижая этим активность ионов малорастворимого электролита. Для точных расчетов в уравнение надо подставлять активности ионов. Гетерогенное равновесие будет смещаться в направлении растворения осадка, и растворимость увеличится. Это явление называется солевым эффектом.
|
|
|
растворимость растворимость
увеличивается уменьшается
3. Конкурирующие гетерогенные процессы.
Реакции ионного обмена между растворимыми и нерастворимыми солями являются конкурирующими гетерогенными процессами. Они направлены в сторону образования наименее растворимого вещества. Рассмотрим возможность реакции между раствором сульфата натрия и твердой фазой карбоната бария:
Na2SO4(aq) + ВаСО3(кр) = Na2CO3(aq) + BaSO4(кр)
Будет ли идти эта реакция обмена и до какого предела? Напишем реакцию в ионной форме, и мысленно разделим ее на две стадии – переход осадка в раствор и образование нового осадка. Для карбоната и сульфата бария выпишем из таблицы константы растворимости:
 ВаСО3 + SO42– = BaSO4 + CO32–
ВаСО3 + SO42– = BaSO4 + CO32–
 |
5,1×10-9 1,1×10-10
CO32- + Ba2+ + SO42-
Мы знаем, что для последовательных реакций общая константа равновесия равна произведению констант отдельных стадий. При этом учитываем, что для сульфата бария следует взять обратную величину константы растворимости, так как рассматривается не переход осадка в раствор, а образование осадка:
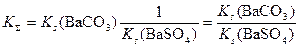
Вычислим константу:
KΣ = 5,1·10-9/1,1·10-10 = 46
Согласно ЗДМ, в растворе устанавливается отношение концентраций анионов


Более растворимый осадок превратится в менее растворимый частично или полностью в зависимости от того, взят ли раствор сульфата натрия в достаточном количестве. Следует отметить что скорость превращения может оказаться небольшой, так как в гетерогенных процессах решающую роль играет величина межфазной поверхности и структура поверхности.
Значительно труднее превратить менее растворимый осадок сульфата бария в более растворимый карбонат бария. Для этого требуется использовать раствор карбоната натрия в большом избытке. Обмен может идти лишь до тех пор, пока
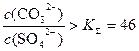
Тогда, при условии Пс > 46, реакция обмена пойдет в обратном направлении:
Na2SO4(aq) + ВаСО3(кр) ← Na2CO3(aq) + BaSO4(кр)
|
|
|
Поэтому раствор над осадком необходимо несколько раз сменить, давая какое-то время на осуществление обмена с осадком. Процесс такого рода можно проводить в потоке раствора:

К конкурирующим гетерогенным процессам можно отнести последовательное образование осадков. Допустим, что раствор содержит хромат натрия и сульфат натрия в равных концентрациях. Добавляют раствор нитрата свинца. Ион Pb2+ может образовать осадки как с ионом CrO42– (K s(PbCrO4) = 1,8·10–14) так и с SO42– (K s(PbSO4) = 1,6·10–8). При постепенном увеличении концентрации ионов свинца произведение концентраций П с ионов Pb2+ и CrO42–, равное K s, будет достигнуто раньше, чем ионов Pb2+ и SO42–. Начнется выделение желтого осадка PbCrO4. После выпадения из раствора всего хромата свинца, концентрация Pb2+ продолжит повышаться, и произойдет выпадение в белого осадка сульфата свинца.

|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 1321; Нарушение авторских прав?; Мы поможем в написании вашей работы!