
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Чем больше константа образования, тем устойчивее комплексное соединение
|
|
|
|
В различных справочниках можно найти таблицы как констант нестойкости, так и констант образования, а также значения р K вместо этих констант.
Расчет концентраций ионов и молекул, образующихся при установлении равновесий ступенчатых реакций образования и распада комплексов представляет собой сложную математическую задачу. Но расчеты значительно упрощаются, если в растворе присутствует достаточно большой избыток свободного лиганда.
Пример 16.1. Рассчитайте концентрацию свободных ионов цинка в растворе нитрата татраамминцинка с концентрацией 0,1 моль/л, содержащем также избыток аммиака 0,5 моль/л.
Решение. Будем считать, что распад комплексных ионов не приведет к существенному увеличению концентрации не связанного в комплекс аммиака. Можно также считать, что распад комплекса в присутствии избытка лиганда не приведет к существенному уменьшению концентрации исходного комплекса. При этих условиях для расчета концентрации свободных ионов цинка можно применить уравнение 14.1:
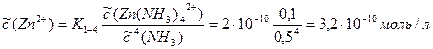
Концентрация свободных ионов цинка настолько мала, что при добавлении к этому раствору карбоната натрия осадок карбоната цинка не образуется.
Расчеты концентраций свободных ионов металлов значительно упрощаются для комплексонатов и макроциклических комплексов. В этих веществах ион металла связан только с одним ионом или молекулой лиганда, распад комплекса идет на две частицы, и в таких процессах расчет производится по формуле закона Оствальда.
Пример 16.2. Рассчитайте концентрацию свободных ионов Са2+ в растворе кальцийэтиледиаминтетраацетата натрия Na2[СаЭДТА] (или короче Na2[СаY]) с концентрацией 0,1моль/л. Константа нестойкости 2,6∙10–11.
|
|
|
Решение. Комплексонат кальция распадается на два иона: Са2+ и ЭДТА4–(Y4–). Диссоциация ионов внешней сферы Na+ на распад комплекса не влияет. Поэтому рассчитываем по формуле Оствальда:
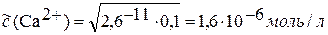
Зная полные константы нестойкости комплексов, можно вычислять константы равновесия реакций замещения лигандов. Рассмотрим реакцию
 [Zn(NH3)4]2+ + 4CN– [Zn(CN)4]2– + 4NH3
[Zn(NH3)4]2+ + 4CN– [Zn(CN)4]2– + 4NH3
K1-4 2,0∙10–10 1,0∙1019
Под формулами записаны константы нестойкости комплексов. Очевидно, что продукт реакции более устойчив, и реакция пойдет в прямом направлении. Как вычислить ее константу равновесия? Мысленно разложим реакцию на стадию распада исходного комплекса и стадию образования конечного продукта:


 [Zn(NH3)4]2+ + 4CN– [Zn(CN)4]2– + 4NH3
[Zn(NH3)4]2+ + 4CN– [Zn(CN)4]2– + 4NH3
4NH3 + Zn2+ + 4CN–
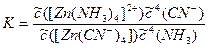
Первая стадия распада характеризуется константой нестойкости аммиачного комплекса, а вторая стадия образования характеризуется обратной величиной константы нестойкости цианидного комплекса. Константа равновесия суммарного процесса равна произведению констант отдельных стадий. Следовательно,
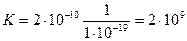
Константа равновесия суммарной реакции велика, и реакция идет в прямом направлении практически необратимо.
Хелатный эффект. Комплексные соединения с полидентатными лигандами более устойчивы, чем с монодентатными, имеющими одни и те же донорные атомы. Это можно объяснить тем, что при разрыве одной из связей бидентатного лиганда комплекс еще не распался, так как одна связь остается. В случае полидентатного лиганда распад еще более затруднен. Сравним устойчивость комплексов цинка с аммиаком и этилендиамином:
[Zn(NH3)4]2+ [Zn(NH2СН2СН2NH2)2]2+
K н 2×10-10 4,3×10-11
Пусть c (ZnL4) = 0,01; c (L) = 0,1, тогда
c (Zn2+) 2×10-8 4,3×10-11
Константа нестойкости комплекса с этилендиамином меньше аналогичной константы аммиачного комплекса несмотря на разную стехиометрию реакций распада. Это приводит к уменьшению концентрации ионов цинка на три порядка при одинаковых начальных концентрациях комплексов и лигандов.
|
|
|
Еще более сильным может быть макроциклический эффект, то есть увеличение прочности комплекса при наличии макроциклического лиганда. Отметим, что скорость образования и распада макроциклических комплексов очень мала. Это затрудняет определение констант равновесия.
 Рассмотрим устойчивость комплексов ионов калия и серебра к коронандами O(CH2O)5CH2CH2 (1) и
Рассмотрим устойчивость комплексов ионов калия и серебра к коронандами O(CH2O)5CH2CH2 (1) и
 S(CH2O)2S(CH2O)2CH2CH2 (2):
S(CH2O)2S(CH2O)2CH2CH2 (2):
| K н | ||
| Коронанд | ||
| K+ | 7,9·10–7 | 7,1·10–2 |
| Ag+ | 2,5·10–2 | 4,6·10–5 |
Из таблицы видно, что ион K+ (жесткая кислота) образует довольно устойчивый комплекс с кислородным коронандом 1. Устойчивость комплекса иона Ag+ (мягкая кислота) значительно ниже. В случае коронанда, в котором два атома кислорода заменены на мягкие атомы серы резко уменьшается устойчивось комплекса с K+ и повышается устойчивость комплекса с Ag+. Мы видим, что здесь «работает» принцип ЖМКО.
Комплексообразование и комплексные соединения в медицине.
Комплексные соединения применяются для корректировки обмена веществ (витамин В12), терапии (комплексы платины), для детоксикации.
Рассмотрим принципы выведения из организма токсических ионов, включая и радионуклиды, которые могут попадать в условиях профессиональной деятельности, в тех или иных случайных ситуациях. Средствами выведения посторонних ионов могут служить комплексоны. Однако свободный комплексон применять нельзя – он в первую очередь связывает необходимые для жизнедеятельности ионы кальция. Поэтому применяется комплексонат кальция Na2[Ca(–O2CCH2)2NCH2CH2N(CH2CO2–)2]. Препарат получил название тетацин-кальций. Коротко обозначим комплексный ион CaY2-. Рассмотрим возможность выведения с его помошью ионов Cr3+.
Напишем реакцию замещения центрального атома:
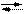 CaY2- + Cr3+ Ca2+ + CrY-
CaY2- + Cr3+ Ca2+ + CrY-
K н 2,6×10-11 4×10-24
Комплекс хрома имеет меньшую константу, равновесие смещено вправо. Связанный ион хрома выводится через почки.
Выведение токсичных ионов тяжелых металлов (элементы 5 и 6-го периодов) осуществляется комплексованием лигандами с мягким донорным атомом серы.
Рассмотрим пример потери активности карбоангидразы (КА) вследствие замещения нативного иона Zn2+ ионами ртути:
|
|
|
 КА-Zn2+ + Hg2+ КА-Hg2+ + Zn2+
КА-Zn2+ + Hg2+ КА-Hg2+ + Zn2+
K н 3×10-11 3,2×10-22
K = 3×10-11/3,2×10-22 = 9,4×1010
Активность можно восстановить, вводя в качестве антидота тиосульфат натрия
 КА-Hg2+ + 2S2O32- КА + [Hg(S2O3)2]2-
КА-Hg2+ + 2S2O32- КА + [Hg(S2O3)2]2-
K н 3,2×10-22 2,4×10-34
K = 3,2×10-22/2,4×10-34 = 1,3×1012
Теперь уже тиосульфат-ион отрывает ион ртути от карбоангидразы, которая может снова присоединить цинк. Ваш лектор работал с химиком, который по производственным условиям «набрал» много ртути, и проходил детоксикацию тиосульфатом нартия. Раствор вводят через капельницу.
Дополнительные примеры.
Комплексные соединения как лекарства
Комплексные соединения железа(II) применяются при пониженном содержании железа: цитрат, фумарат, лактат, глицерофосфат и др.
Миокризин Cl-Au-S(CH2COONa)2 при артритах (в настоящее время не применяется, но есть и другие препараты)
Тетрасукцинимидозолото(III) Au-(NCOCH2CH2CO)4-
Детоксиканты
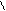
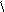
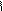
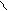
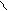 БАЛ CH2CHCH2 и унитиол CH2CHCH2-SO3Na
БАЛ CH2CHCH2 и унитиол CH2CHCH2-SO3Na
SH SH OH SH SH
Пеницилламин – выведение меди
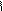 H3C
H3C
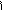
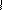
 HS-C-CH-C=O
HS-C-CH-C=O
H3C NH2 OH
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 840; Нарушение авторских прав?; Мы поможем в написании вашей работы!