
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Конкурирующие процессы и совмещенные равновесия тесно связаны между собой. Различие состоит лишь в характере начального состояния системы
|
|
|
|
Рассмотрим реакции, протекающие при добавлении раствора хлорида кальция к раствору, содержащему две соли – оксалат и этилендиаминтетра-ацетат натрия.

Здесь возможно как образование комплексоната кальция, так и осадка практически нерастворимой соли оксалата кальция:
 + ЭДТА4– = [CaЭДТА]2–; K =
+ ЭДТА4– = [CaЭДТА]2–; K = = 3,9×1010
= 3,9×1010
 Ca2+
Ca2+
+ С2О42– = СаС2О4↓; K = = 4,3×108
= 4,3×108
Из значений констант, очевидно, что в первую очередь пойдет реакция образования комплекса. Когда почти полностью будут связаны ионы ЭДТА4–, то при дальнейшем добавлении хлорида кальция начнется выпадение осадка СаС2О4.
Поставим опыт иначе. В сосуде имеется вода с осадком оксалата кальция на дне. В этот сосуд добавляем раствор этилендиаминтатраацетата натрия.

Осадок реагирует с раствором, и ион кальция переходит в состав комплекса. Вопрос заключается в том, при каких концентрациях установится равновесие реакции
CaC2O4 + ЭДТА4- = [CaЭДТА]2- + C2O42-?
Это равновесие сложное, или совмещенное. Общей частицей, участвующей как в прямой, так и в обратной реакции, является ион Са2+. Ниже мы рассмотрим, как рассчитываются константы совмещенных равновесий.
Следует сказать, что бывают не только конкурирующие, но и синергические процессы, то есть такие, в которых один процесс способствует протеканию другого. Мы уже знаем, что гемоглобин, связывающий и транспортирующий кислород, представляет собой кислоту, и создает одну из буферных систем крови.
 H–Hb–Fe2+ + Н2О Hb––Fe2+ + H3О+ pK = 8,2
H–Hb–Fe2+ + Н2О Hb––Fe2+ + H3О+ pK = 8,2
Связывая кислород, гемоглобин превращается в оксигемоглобин, проявляющий более сильные кислотные свойства:
 H–Hb–Fe2+ + О2 H–Hb–Fe2+–О2
H–Hb–Fe2+ + О2 H–Hb–Fe2+–О2
 H–Hb–Fe2+-О2 + Н2О Hb––Fe2+-О2 + H3О+ pK = 6,95
H–Hb–Fe2+-О2 + Н2О Hb––Fe2+-О2 + H3О+ pK = 6,95
Связывание кислорода усиливает диссоциацию. В этом проявляется синергизм. На примере гемоглобина синергизм проявляется и в том, что после связывания первой молекулы кислорода, гемоглобин легче присоединяет еще 3 молекулы О2.
|
|
|
Гемоглобин может связывать не только молекулы кислорода, но и молекулы угарного газа СО
 H–Hb–Fe2+ + СО H–Hb–Fe2+-СО
H–Hb–Fe2+ + СО H–Hb–Fe2+-СО
Константа равновесия при связывании СО в 300 раз превышает константу равновесия связывания кислорода:
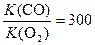
Конкуренция за присоединение к молекуле гемоглобина проявляется в токсичности угарного газа. Почему же в одних случаях проявляется конкуренция в протекании процессов, а в других – синергизм? Дело в том, что присоединение кислорода и угарного газа идет к одному реакционному центру (Fe2+), и эти процессы оказываются конкурирующими. Процессы на разных центрах могут быть синергическими. Присоединение кислорода к железу в гемоглобине не мешает, а способствует переносу протона.
Рассмотрим несколько примеров разнотипных конкурирующих процессов и совмещенных равновесий и подход к расчету констант равновесия этих процессов.
Совмещенные гетерогенный – протолитический процессы.
Осадок фторида лития реагирует с раствором хлороводорода:
 LiF(кр) + HCl LiCl + HF
LiF(кр) + HCl LiCl + HF
Напишем реакцию в ионной форме и мысленно разобьем ее на две последовательные стадии – растворение осадка и образование слабой кислоты:


 LiF(кр) + H+ HF + Li+
LiF(кр) + H+ HF + Li+
K s = 1,7×10–3 K = 1/ K a=1/6,2×10–4=1,61×103

 Li+ + F– + H+
Li+ + F– + H+
Общая константа равновесия последовательных реакций равна произведению констант по первой и второй стадиям: K S = 1,7×10-3×1,61×103=2,74.
Можно также сказать, что K S – это отношение констант диссоциативного типа исходных веществ и конечных продуктов:

В стандартном состоянии (при с (H+) = с (HF) = с (Li+) = 1) реакция идет слева направо.
Уравнение закона действующих масс (ЗДМ) для совмещенного равновесия:

Перейдем к рассмотрению совмещенного равновесия, в котором объединены гетерогенная и окислительно-восстановительная реакции:
|
|
|

 PbI2(кр) + 2Fe3+ = Pb2+ + I2 + 2Fe2+
PbI2(кр) + 2Fe3+ = Pb2+ + I2 + 2Fe2+
φº, В 0,77 В 0,54
K s = 1,1×10–9 K ов= 6,1×107

 Pb2+ + 2I- + 2Fe3+
Pb2+ + 2I- + 2Fe3+
|
KS = Ks×Kов =1,1×10-9×1,6×107=6,7×10-2

|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 639; Нарушение авторских прав?; Мы поможем в написании вашей работы!