
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Биогенные s-элементы
|
|
|
|
Сегодня мы рассмотрим только металлы IA и IIA групп. s - Элемент водород, образующий ковалентные связи, по своей роли подобен р - элементам, и мы поговорим о нем в следующей лекции.
Четыре распространенные в природе элемента – K, Na, Mg, Ca – составляют тесную группу в таблице Менделеева. Они также близки по распространенности в природе и по своей роли в жизнедеятельности. Атомы этих элементов образуют устойчивые, не подверженные изменению заряда, ионы K+, Na+, Mg2+, Ca2+. Свойства ионов приведены в таблице.
Свойства некоторых ионов s -элементов
| Li+ | Na+ | K+ | Rb+ | Мg2+ | Са2+ | |
| r (Mz+), пм | ||||||
| r (Mz+)×aq, пм | ||||||
| N (H2O) | 25,3 | 16,6 | 10,5 | |||
| К.Ч. | 4,6 | 6,8 | 4 и 6 | 6 и 8 | ||
| Е гидр, кДж/моль |
Однозарядные ионы K+, Na+ почти не дают нерастворимых соединений, не связываются с обычными лигандами, находятся водном растворе в гидратированном состоянии. Тем не менее, клетки способны различать эти ионы. Эта способность, по видимому, основана на различии их радиусов. Следует учитывать, что радиусы гидратированных ионов изменяются в обратном порядке относительно не гидратированных ионов. Натрий находится в окружающих клетки жидкостях, в том числе в плазме крови. Калий преимущественно внутриклеточный катион:
Na+ – 11 ммоль/л в клетке; 146 ммоль/л вне клеток
K+ – 115-125 ммоль/л в клетке; 3,5-5,5 ммоль/л вне клеток
Такое распределение ионов поддерживается особым механизмом, называемым калий-натриевым насосом. На его работу затрачивается свыше 20% потребляемой клетками энергии. Из этого косвенно видна огромная роль ионов. Ионы проходят через особые мембранные каналы. При этом они дегидратируются и связываются с фосфатами, а также ионофорами. Мы уже говорили о макроциклических лигандах краунэфирах. В клетках есть также пептидные ионофоры. Антибиотик валиномицин избирательно свызывает калий и проносит через гидрофобную мембрану. Это ведет к гибели клеток бактерий. В процессе проведения нервного импульса в зоне возбуждения поток ионов натрия идет в клетку, а а ионов калия – навстречу им. В период сна восстанавливается распределение ионов. На катион натрия в составе NaCl возложена задача поддержания необходимого осмотического давления плазмы крови. Избыток натрия наименее опасен для жизнедеятельности по сравнению с другими ионами.
|
|
|
Для понимания механизмов биохимических процессов связанных с участием катионов s -элементов, следует учитывать, что однозарядные катионы, и тем более двухзарядные все же образуют в растворах комплексы с анионами, хотя и очень неустойчивые. Определение констант образования было проведено сравнительно недавно (см. таблицу).
Константы образования
| Li+ | Na+ | K+ | Mg2+ | Ca2+ | |
| ЭДТА (Y4-) | 8×108 | 5×1010 | |||
| SO42- | 4,3 | 5,1 | 9,1 | ||
| NO3- | 0,03 | 0,32 | 1,9 | ||
| P2O72- | 6,2×105 | 1×105 | |||
| валиномицин | 4.7 | ||||
| 18-краун-6 |
Константы образования комплексов однозарядных ионов, в целом, довольно малы. Можно отметить сравнительно большое значение константы образования ионов натрия с пирофосфатом. Это имеет значение для избирательного переноса ионов Na+ через клеточную мембрану.
Двухзарядные ионы кальция и магния проявляют уже иные свойства. Они образуют практически нерастворимые соединения с большинством двухзарядных анионов, и тем более трехзарядными. Поэтому соли кальция составляют минеральную часть скелета. В костях депонируются и примесные элементы – стронций, свинец, фтор и др.
Ионы магния и кальция образуют комплексные соединения с полидентатными лигандами: этилендиаминтетраацетаты, цитраты (соли лимонной кислоты), соединения с белками. Поэтому тот незначительный по концентрации остаток ионов кальция, который не вошел в состав солей скелета, находится в биологических жидкостях приблизительно на 50% в гидратированном виде, и столько же в соединениях с белками, низкомолекулярными пептидами и др.
|
|
|
Содержание ионов s -элементов, ммоль/л
| Масса, г | Моль | Плазма ммоль/л | Эритроциты ммоль/л | |
| Na+ | 4,35 | |||
| K+ | 3,59 | 3,1 – 5,5 | 92 – 125 | |
| Ca2+ | 2,5 | 0,1 | ||
| Mg2+ | 0,78 | 2,5 | ||
| Cl- | 2,68 |
Магний концентрируется внутри клеток, а кальций вне клеток. При общем содержании магния 19 г, в среднем 8,4 г находится в скелете, а остальное в мягких тканях. Недостаток магния в организме возникает сравнительно редко. Значительная часть ионов магния связана с аденозинфосфатами, которые фактически участвуют в реакциях фосфорилирования в виде магниевых солей
 O O O
O O O


 –O–P–O–P–O–P–O–A (А – аденозин)
–O–P–O–P–O–P–O–A (А – аденозин)
O– O– O–
Mg2+
Ионы магния необходимы для активирования некоторых ферментов. Например, транскетолаза активируется коферментом тиаминдифосфатом в форме магниевой соли.
Особенно многообразно участие в биологических процессах ионов кальция. Из массы кальция в среднем 1000 г, имеющейся в теле человека, лишь около 1,5 г находится в жидкостях в виде растворимых соединений, а остальной кальций в составе гидроксидфосфата образует минеральную основу скелета. Образование гидроксидфосфата кальция можно представить так. Сначала образуются микрокристаллы малорастворимого гидрофосфата кальция
Ca2+ + HPO42– = CaHPO4(тв)
Гидрофосфат-ионы частично нейтрализуются с образованием более сложной формы гидрофосфата кальция:
3CaHPO4(тв) + 2OH– + Ca2+ = Ca4H(PO4)3(тв) + 2H2O
При окончательной нейтрализации образуются кристаллы гидроксидфосфата кальция:
Ca4H(PO4)3(тв) + 2OH– + Ca2+ = Ca5(OH)(PO4)3(тв) + 2H2O
Растворенный кальций это преимущественно внеклеточный катион. Известно несколько механизмов поддержания пониженной концентрации Са2+ внутри клетки относительно окружающей жидкости. Один из механизмов – так называемый Ca2+/Na+-насос. За счет переноса трех ионов Na+ в клетку по градиенту концентрации, из клетки выбрасывается один ион Ca2+ против градиента концентрации:
|
|
|
3Na+(внеклет.) + Ca2+(клет.) = 3Na+(клет.) + Ca2+(внеклет.)
Концентрация внеклеточного кальция поддерживается точно на уровне 5 ммоль/л. Стабилизация концентрации ионов Ca2+ обеспечивается действием кальциевого буфера, аналогичного кислотно-основному буферу. Источником ионов служат минеральные соли в костях, а связывающими кальций компонентами – свободные лиганды в жидкостях. Концентрация свободных ионов Ca2+ внутри клеток в 1000 и более раз ниже, чем в клетке. Но в клетке при этом имеется кальций, связанный с клеточными органеллами. Довольно часто встречаются нарушения гомеостаза кальция. Это связано с многочисленностью процессов, зависящих от кальция. Перечислим лишь некоторую часть этих процессов: формирование костной ткани, запуск сокращения скелетных и сердечных мышц, регуляция нервной деятельности, процесс синаптической передачи импульса, механизм работы зрительной клетки, коагуляция крови и тромбогенез, влияние на работу почек, влияние на работу эндокринных желез, участие в патогенезе клеток и тканей. Сдвиги гомеостаза кальция проявляются в острой патологии гипокальциемии (сильное понижение концентрации кальция) и гиперкальциемии (сильное повышение концентрации кальция).
Особенности иона Ca2+, которыми обусловлено его участие в многочисленных процессах, можно свести к наличию достаточно высокого положительного заряда, координационного числа, достигающего значения 8 и большой скорости обмена частиц, связанных с кальцием. Реакции замещения на ионе кальция идут приблизительно на 3 порядка быстрее, чем на ионе магния. Наиболее характерно для кальция связывание с кислородными лигандами. Высокое координационное число позволяет иону Ca2+ скреплять молекулы, образующие мембраны. Например, фосфолипиды в цитоплазматической мембране.
Известно более 100 Ca2+-связывающих белков. Среди них всесторонне изучен кальмодулин. Это регуляторный белок с Mr =17000. В этом белке 4 центра связывания кальция. Константы связывания составляют около 1·106. Связывание кальция по всем четырем центрам ведет к заметному изменению конформации. С этим связана способность кальмодулина активировать или инактивировать ферменты. Таких ферментов насчитывается около двух десятков.
|
|
|
С процессами обмена кальция связан необычный пептид кальцитонин, состоящий из 32 остатков аминокислот, и имеющий концевую петлю из семи остатков с дисульфидным мостиком. Такая петля может быть хозяином для связывания гостя (вспомните терминологию в лекции по комплексным соединениям).
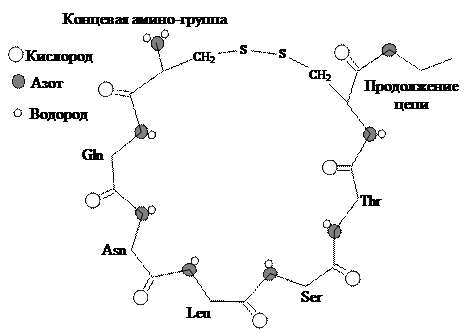
Концевой цикл кальмодулина
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 1293; Нарушение авторских прав?; Мы поможем в написании вашей работы!