
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Устойчивость и коагуляция коллоидно-дисперсных систем
|
|
|
|
Коагуляция – разделение на среду и коагулят.
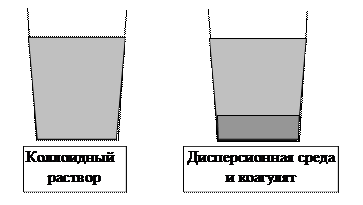
Рис. 6. Оседание коагулята
Различают два вида устойчивости – кинетическую и агрегативную.
Кинетическая – равновесие между диффузией и седиментацией.
Агрегативная – сопротивление слипанию и укрупнению частиц.
Различают также скрытую и явную коагуляцию. При скрытой коагуляции идет слипание частиц, но еще не начинается седиментация. Внешний вид системы не изменяется. Явная коагуляция проявляется в изменении окраски коллоидного раствора, помутнении и возникновении седиментации.
Факторы устойчивости – электростатическое отталкивание заряженных гранул и расклинивающее давление среды.
Факторы, вызывающие коагуляцию – повышение температуры, механические воздействия, изменение состава среды (добавление органических жидкостей к воде), облучение, добавление электролитов.
Механизм действия коагулирующих факторов это снижение электрокинетического потенциала. Сжатие двойного электрического слоя. Обычно коагуляция начинается при понижении электрокинетического потенциала до 30 мВ.
Правило Шульце-Гарди. Коагулирующая способность электролита зависит от знака и величины заряда. Коагулирующее действие производят ионы с противоположным зарядом относительно гранулы. Пороговые концентрации находятся в следующих пределах:
Х+ – 25 – 150 ммоль/л
Х2+ – 0,5 – 2 ммоль/л
Х3+ – 0,01 – 0,1 ммоль/л
Теоретически вычисленное отношение пороговых концентраций коагулирующих ионов
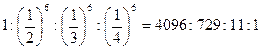
Порог коагуляции Шульце (1882), Гарди (1900)
У органических ионов коагулирующее действие возрастает вместе с адсорбционной способностью. У неорганических возрастает с уменьшением гидратации.
|
|
|
Коагулирующая способность выражается обратной величиной пороговой концентрации

| Li+ | Na+ | K+ | Ca2+ | Al3+ | |
| с порог | 0,65 | 0,098 | |||
| 1/ с порог | 0,017 | 0,2 | 0,2 | 1,5 |
Теория была разработана независимо советскими и английскими учеными, и называется теорией ДЛФО (Дерягин-Ландау-Фервей-Овербек).
Пептизация – переход осажденной дисперсной фазы в коллоидный раствор. Различают адсорбционную и химическую пептизацию.
Гранулы гидроксида железа адсорбируют избыток ионов Fe3+,, и благодаря увеличению положительного заряда переходят в коллоидный раствор. Если же к осадку Fe(OH)= добавляют соляную кислоту, то часть осадка вступает в реакцию, а остаток заряжается и переходит в коллоидный раствор. Результат одинаковый.
Коллоидная защита. ПАВ и ВМВ лиофилизируют частицы дисперсной фазы; уменьшается поверхностное натяжение и образуется сольватный слой. Поверхность частицы приобретает свойства вещества-стабилизатора. Коллоидная защита зависит от прочности закрепления защищающего вещества на поверхности частицы.
Золотое число (Р. Зигмонди) – Минимальная масса стабилизатора (в мг), которая предотвращает коагуляцию 10 мл золя золота (переход окраски из пурпурной в синюю) при добавлении 1мл 10%-го раствора хлорида натрия.
Желатина – 0,01
Гуммиарабик – 0,05
Крахмал – 20
Способность адсорбироваться
SO42– < Cl– < Br– < NO3– < I – < SCN– …< OH–
Na+ < K+ < Mg2+ < Ca2+ < Ba2+ < Al3+ < Fe3+ < H+
Отношение пороговых концентраций 1-2-3-4-зарядных ионов
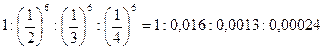
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 449; Нарушение авторских прав?; Мы поможем в написании вашей работы!