
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантово-механическая теория химической связи
|
|
|
|
Описание химической связи – это описание распределения электронной плотности в молекуле.
Существуют 2 способа описания химической связи:
– метод валентных связей,
– метод молекулярных орбиталей.
Представления о механизме образования химической связи, развитые на примере молекулы водорода, были распространены и на более сложные молекулы. Разработанная на этой основе теория химических связей получила название метода валентных связей (метод ВС).
В основе метода валентных связей лежит положение о том, что любая ковалентная химическая связь возникает в результате взаимодействия двух электронов с противоположно направленными спинами, причём изначально эти электроны принадлежат различным атомам, а образующаяся общая электронная пара – обоим атомам. Такой механизм образования ковалентной связи называется обменным механизмом. Именно по обменному механизму образованы химические связи в молекулах водорода и хлороводорода:

Согласно методу ВС ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
При образовании химической связи происходит уменьшение общей энергии системы:
А + В → АВ
Е1 Е2 Е3
Е1 + Е2 > Е3
Введем понятие валентность.
Валентность – это способность атомов образовывать химические связи.
Например: водород Н – валентность 1, гелий Не – 0.
Валентность атомов может совпадать с числом неспаренных электронов в основном состоянии (состоянии покоя)
Валентность может и не совпадать с числом неспаренных электронов в основном состоянии:
4Ве 1S22S22p0

Такому состоянию соответствует нулевая валентность, но если подвести энергию Е=250 кДж/моль, то валентность будет равна 2.
|
|
|

Данный переход возможен благодаря тому, что при образовании у Ве 2-х химических связей выделилась энергии больше, чем ушло на возбуждение атомов.
Например, у 2Не 1S2 данный переход не выгоден.

Данный переход не выгодный, поэтому что гелий (Не) сохраняет нулевую валентность.
Бор: 5В 1S22S22p1, валентность равна 3.
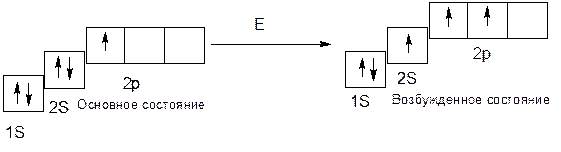
Углерод: 6С 1S22S22p2, в основном состоянии углерод имеет валентность 2, а в возбужденном состоянии – 4, т.е.

Хлор: 17Cl, 3S23p5, в основном состоянии углерод имеет валентность 1, а в возбужденном состоянии – 3, 5, 7.

Переходы электронов при возбуждении атомов возможны только в пределах энергетического уровня, без изменения главного квантового числа.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 3960; Нарушение авторских прав?; Мы поможем в написании вашей работы!