
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Металлическая связь
|
|
|
|
Металлическая связь – это связь между атомами в кристаллах металла.
У металлов имеется избыток валентных орбиталей и недостаток электронов. При сближении атомов в результате образования кристаллической решетки валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются из одной орбитали в другую, осуществляя связь между всеми атомами кристалла металла. Таким образом, в металлах небольшое количество электронов связывает большое количество атомных ядер. Связь является сильно делокализованной. Согласно одной из теорий металл можно рассматривать как плотно упакованную структуру из положительно заряженных ионов, связанных друг с другом электронным газом.
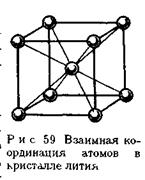 Металлическую связь нельзя отнести ни к ионному, ни к ковалентному типу. Например, литий кристаллизуется в кубической объемно-центрированной решетке, и каждый его атом имеет в кристалле по восемь близлежащих соседних атомов.
Металлическую связь нельзя отнести ни к ионному, ни к ковалентному типу. Например, литий кристаллизуется в кубической объемно-центрированной решетке, и каждый его атом имеет в кристалле по восемь близлежащих соседних атомов.
Для образования ковалентной связи атом лития должен был бы представить восемь электронов, что невозможно, так как он имеет лишь один валентный электрон. В кристалле лития каждый атом представляет на связь четыре валентные орбитали и всего лишь один валентный электрон. Число электронов в кристалле значительно меньше числа орбиталей, кроме этого атомы металлов отличаются невысокой степенью ионизации – валентные электроны слабо удерживаются в атоме и легко перемещаются по всему кристаллу.
Возможность перемещения электронов по кристаллу определяет высокую электрическую проводимость металлов.
Практически не наблюдается чисто металлической связи, т.к. из-за электростатического притяжения ядер электроны чаще, чем в других областях пространства решетки металла, фиксируются между данными двумя атомами, образуя ковалентную связь. Причем, чем больше заряд ядра и меньше радиус атома, тем больше ковалентная составляющая связи и тем более прочен металл.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 355; Нарушение авторских прав?; Мы поможем в написании вашей работы!