
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Одеса ОДАХТ 2001
|
|
|
|
Затверджено
МЕТОДИЧНІ ВКАЗІВКИ
Товарна інноваційна політика
НАВЧАЛЬНЕ ВИДАННЯ
до виконання контрольної роботи з дисципліни «Товарна інноваційна політика» для студентів 5-го курсу заочної форми навчання спеціальності 7.-8.03050701 "Маркетинг"
Укладачі Карпій Олена Петрівна
Хтей Наталя Іванівна
Балик Уляна Олегівна
Васильців Надія Михайлівна
Редактор
Підписано до друку
Формат 70´100 1/16. Папір офсетний.
Друк на різографі. Умовн. друк. арк. 1,95. Умовн. фарбо-відб.
Тираж 50 прим. Зам.
Видавництво Національного університету "Львівська політехніка"
вул. Ф.Колесси, 2, 79000, Львів
на засіданні методичної ради
спеціальності 7.091702.
Протокол № 5
від “ 22 ” травня 2001 р.
Конспект лекцій з курсу “Неорганічна хімія” для студентів, що навчаються за навчальними планами для бакалаврів спеціальностей 7.091701, 7.091702, 7.091704, 7.091706, 7.091707, 7.091708, 7.091709, 7.091711 та 7.070801 денної та заочної форм навчання/ Уклали: Андріянов О.Д., Гуляєнко О.Б., Іванова Р.Ю., Короленко Л.І., Петросян В.П., Чарський В.В.,– Одеса: 2001 – 98 с.
Укладачі:О.Д.Андріянов, доц., к.х.н.
О.Б.Гуляєнко, доц., к.х.н.
Р.Ю.Іванова, доц., к.х.н.
Л.І.Короленко, доц., к.х.н.
В.П.Петросян, доц., к.х.н.
В.В.Чарський, доц., к.б.н.
Відповідальний за випуск – завідувач кафедри НЗХ доц. Андріянов О.Д.
Курс “Неорганічна хімія” – базовий курс хімічної підготовки для інженерів-техологів. Вивчення цього предмету повинно забезпечити розширення загальної ерудиції студентів технологічних спеціальностей, створити підґрунтя для вивчення наступних хімічних і технологічних дисциплін. Цей курс дозволяє студентам харчових технологічних фахів 7.091700, а також студентам фаху 7.091801 – екологія харчових вироб-ництв набути фундаментальних знань із загальної та неорганічної хімії глибше зрозуміти процеси, що відбуваються у природі та техніці, закони розвитку та руху хімічного рівня матеріального світу. Знання неорганіч-ної хімії необхідне для повноцінної творчої діяльності інженерів зазначе-них фахів. Даний курс лекцій охоплює лише першу частину усього курсу “Неорганічна хімія” – основні питання загальної хімії. Курс складено на основі матеріалів лекцій, що читаються студентам Одеської державної академії харчових технологій на І курсі та у підсумку вивчення новітньо-го матеріалу з питань загальної хімії викладачами кафедри неорганічної та загальної хімії зазначеної академії. Посібник можна використовувати як допоміжний матеріал при вивченні згадуваного курсу, підготовки до колоквіумів, контрольних, залікових та екзаменаційних робіт.
|
|
|
Тема 1. ОСНОВНІ ПОНЯТТЯ ТА ЗАКОНИ ХІМІЇ
Молекула – найдрібніша частинка даної речовини, яка володіє усіма хімічними властивостями цієї речовини.
Атом – найдрібніша частинка хімічного елемента, що зберігає його хімічні властивості.
Сучасне формулювання: атом – електронейтральна частинка, що складається з позитивно зарядженого ядра та негативно зарядженої електронної оболонки.
Хімічний елемент – вид атомів з однаковим зарядом ядра.
Проста речовина – речовина, утворена атомами одного елемента.
Складна речовина або хімічна сполука – речовина, утворена атомами різних елементів.
Атомна одиниця маси (а.о.м.) являє собою 1/12 частину атомної маси атома вуглецю 12С.
Відносна атомна маса елемента (Аr) – маса одного атома елемента, виражена в атомних одиницях маси.
Відносна атомна маса елемента показує у скільки разів маса атома даного елемента більше 1/12 частини маси атома вуглецю 12С.
|
|
|
Відносна молекулярна маса речовини (Мr) – величина, що дорів-нює відношенню середньої маси молекули природної речовини до 1/12 частини маси атома вуглецю 12С.
Відносна молекулярна маса речовини чисельно дорівнює сумі від-носних атомних мас, що входять до складу молекули даної речовини. Відносна молекулярна маса показує у скільки разів маса молекули даної речовини більше 1/12 частини маси атома вуглецю 12С.
Моль – це кількість речовини, що містить стільки структурних одиниць (молекул, атомів, іонів, електронів, тощо), скільки атомів міститься в 0,012 кг ізотопу вуглецю 12С.
Число частинок у молі будь-якої речовини однакове і становить 6,02×1023 моль-1. Це число називається сталою Авогадро (NA).
Молярна маса (М) – маса речовини, взятої у кількості 1 моль. Вона дорівнює відношенню маси речовини (m) до кількості речовини (n):
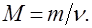
Розмірність молярної маси: кг/моль, г/моль. У загальному випадку молярна маса речовини виражається у г/моль та чисельно дорівнює її від-носній молекулярній масі.
Закон збереження маси речовини
Маса речовин, що вступають до хімічної реакції дорівнює масі речо-вин, що утворюються внаслідок цієї хімічної реакції. Закон було вперше сформульовано у 1748 році М.В.Ломоносовим.
Закон сталості складу речовин
Будь-яка чиста речовина незалежно від способу її одержання завжди має сталий якісний та кількісний склад. Закон було відкрито у 1808 році Ж.Л.Прустом.
Розвиток хімії показав, що поряд із речовинами сталого складу, існу-ють і речовини зі змінним складом. Перші названо долтонідами (на честь відомого англійського хіміка Дж.Долтона), а другі – бертолідами (на честь французького хіміка К.Л.Бертоле). Склад долтонідів виражається простими хімічними формулами з цілочисельними стехіометричними індексами, наприклад: Н2О, ВСl3, С6Н12О6. Склад бертолідів змінюється й у них нецілочисельні (дробні) стехіометричні індекси, Так, наприклад, оксид титану (ІІ) має склад від TiO0,7 до TiO1,3. У зв’язку з цим у сучасне формулювання закону слід внести уточнення: склад сполук із молекуляр-ною будовою є сталим і не залежить від способу їх одержання. Склад сполук із не молекулярною будовою (атомною, йонною, металевою кристалічними решітками) залежить від умов одержання.
|
|
|
Закон кратних відношень
Якщо два елементи утворюють між собою кілька сполук, то масові кількості одного елемента, що сполучаються з однією й тією ж масовою кількістю іншого елемента, відносяться між собою, як невеликі цілі числа.
Еквівалент елемента. Закон еквівалентів.
Еквівалент складної речовини
Хімічним еквівалентом елемента називається така його кількість, яка сполучається з 1 молем атомів водню чи заміщує таку ж кількість атомів водню у хімічних реакціях. Величина еквіваленту виражається в молях.
Еквівалентна маса – маса одного еквіваленту елемента (речовини); одиниця вимірювання еквівалентної маси – г/моль (кг/моль).
Обчислити еквівалентну масу елемента у сполуці можна визначити з наступного співвідношення: 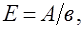
де А – молярна маса елемента, в – його валентність у сполуці.
Так еквівалентна маса кисню (в оксидах) дорівнює:
Е (О) = 16/2 = 8 г/моль.
Закон еквівалентів
Речовини взаємодіють між собою у кількостях пропорційних їхнім хімічним еквівалентам: 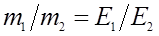 .
.
де m1 та m2 – маси взаємодіючих речовин (г), Е1 та Е2 – їхні еквівалентні маси (г/моль).
Еквівалентний об’єм (VE) – об’єм, який займає за нормальних умов еквівалент речовини. Наприклад еквівалентний об’єм кисню дорівнює 5,6 л, а еквівалентний об’єм водню – 11,2 л. У тому випадку, якщо одна з речовин газ, математичний запис закону еквівалентів виглядає наступним чином: 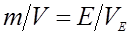 .
.
Еквівалентом складної речовини є така її кількість, яка у даній реакції взаємодіє з одним еквівалентом водню чи одним еквівалентом ін-шої речовини. Еквівалентною масою кислоти є її молярна маса поділена на її ж основність (точніше, кількість заміщених катіонів водню у тій чи іншій реакції). Еквівалентною масою основи є молярна маса поділена на її кислотність (точніше, кількість аніонів гідроксилу, заміщених на кислотні залишки у тій чи іншій реакції). Еквівалентною масою солі дорівнює молярній масі, поділеній на сумарний заряд позитивних або негативних іонів формульної одиниці цієї солі.
Газові закони
Закон об’ємних відношень Гей-Люсака
|
|
|
Об’єми газів, що вступають до реакції відносяться один до іншого, а також до об’ємів одержуваних газоподібних продуктів як невеликі цілі числа. Наприклад: 1 л хлору сполучається з одним літром водню, у під-сумку чого утворюється 2 л хлороводню.
Закон Авогадро
В однакових об’ємах газів за однакових умов (температура, тиск) містяться однакові кількості молекул.
Наслідки із закону Авогадро:
1. За нормальних умов (to = 0oC, p = 101,3 кПа) один моль будь-якого газу займає один і той самий об’єм, що дорівнює 22,4 л. Цей об’єм називається молярним об’ємом газу (VM). Молярний об’єм – це відношення об’єму газоподібної речовини до кількості цієї речовини: 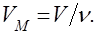
2. Відношення маси певного об’єму одного газу до маси такого ж об’єму другого газу називається відносною густиною першого газу за другим (позначається літерою D).
Враховуючи, що із закону Авогадро випливає, що m1: m2 = M1: M2, можна записати, що 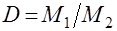 або
або 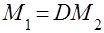 .
.
Звичайно густини визначають за найлегшим газом – воднем ( Молекулярна маса речовини у газоподібному стані дорівнює його подвоєній густині за воднем у а.о.м., а молярна маса цієї речовини стільки ж, тільки у г/моль. Якщо відома густина за повітрям (Dпов.), то М = 29Dпов., бо середня молярна маса повітря дорівнює 29 г/моль. Закон Бойля-Маріота При сталій температурі тиск, який спричинює певна маса газу обернено пропорційний об’єму цієї маси газу: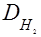 ). Молярна маса водню дорівнює 2 г/моль, звідси М = 2
). Молярна маса водню дорівнює 2 г/моль, звідси М = 2 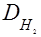 .
.
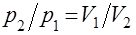 або pV = const.
або pV = const.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 492; Нарушение авторских прав?; Мы поможем в написании вашей работы!