
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водневий показник
Застосуємо закон дії мас для процесу дисоціації води. Чиста вода дисоціює в дуже незначній мірі. Ступінь дисоціації води (a) дорівнює 1,8· ∙10-9, тобто з 550.000.000 молекул дисоціює лише одна. Вода дисоціює як амфотерний електроліт: 2Н2О ↔ Н3О+ + ОН-
або спрощено: Н2О ↔ Н+ + ОН-.
Запишемо константу дисоціації води:
Кд (Н2О) = 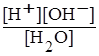 .
.
Експериментально встановлено, що Кд (Н2О) = 1,8 ∙ 10-16 при 25оС.
[H+] ∙ [OH-] = [H2O] · Кд (Н2О). Позначимо [H2O] · Кд (Н2О) через К(Н2О) чи Кw. Величина Кw (добуток концентрації катіонів водню на концентрацію аніонів гидроксилу) називається йонним добутком води та є величиною сталою при даній температурі. Знайдемо чóму дорівнює величина Кw. Оскільки ступінь дисоціації води дуже малий, то й дуже ма-ла концентрація молекул, що розпалися у порівнянні з концентрацією не-дисоційованих молекул, тому останню можна вважати сталою та рівною 55,56 моль/л (число молів води в 1 л при 25оС). Підставляючи це значення у вираз константи дисоціації води, одержуємо при 25оС:
[H+] ∙ [OH-] = 1,8 ∙ 10-16 ∙ 55,56 = 1,008 ∙ 10-14 ≈ 10-14.
Це дуже важлива величина, оскільки дозволяє для будь-якого розчи-на знайти концентрації йонів водню та гідроксилу.
Для чистої води [H+] = [OH-] = 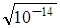 = 10-7 моль/л. Розчини, у яких концентрація йонів водню дорівнює концентрації йонів гідроксильних груп і дорівнює 10-7 моль/л називаються нейтральними.
= 10-7 моль/л. Розчини, у яких концентрація йонів водню дорівнює концентрації йонів гідроксильних груп і дорівнює 10-7 моль/л називаються нейтральними.
Якщо у воду додати кислоту, то [H+] > 10-7 моль/л (10-6, 10-5 і т.д.), а [OH-] станет меньше, 10-7 моль/л, оскільки [OH-] = 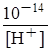 . Припустимо [H+] = 10-6 моль/л, тоді [OH-] = 10-8 моль/л. Отже, у кислих розчинах концентрація катіонів водню більше 10-7 моль/л.
. Припустимо [H+] = 10-6 моль/л, тоді [OH-] = 10-8 моль/л. Отже, у кислих розчинах концентрація катіонів водню більше 10-7 моль/л.
Якщо у воду додати луг, то [H+] стане менше 10-7 моль/л (10-8, 10-9 і т.д.). Отже, у лужних розчинах концентрація катіонів водню менше 10-7 моль/л.
Для зручності кислотність середовища характеризують не такими малими величинами, а користуються так званим водневим показником.
Водневий показник – це від’ємний десятковий логарифм концентра-ції катіонів водню: рН = – lg [H+]. Наприклад: якщо [H+] = 10-4 моль/л, то рН = 4 (середовище кисле); якщо [H+] = 10-9 моль/л, то рН = 9 – (середо-вище лужне); Аналогічно означується і гідроксильний показник рОН:
рОН = – lg [ОH-]; рН + рОН = 14.
Якщо рН = 7, то середовище нейтральне;
якщо рН менше 7, то середовище кисле;
якщо рН більше 7, то середовище лужне.
Для багатьох процесів величина рН має велике значення. Так, рН крові здорової людини має суворо певне значення (7,4). Рослини можуть нормально зростати лише за певних значень рН грунту. Тому для дуже кислих грунтів застосовують метод вапнування грунтів. Властивості при-родних вод також сильно залежать від їхнього рН.
Поняття про індикатори.
Для вимірювання рН середовища існують різноманітні методи. На-ближено кислотність розчину можна визначити при допомозі спеціальних розчинів – індикаторів. Індикатори – це речовини, забарвлення яких змі-нюється у залежності від концентрації катіонів водню (рН середовища).
Найчастіше у якості індикаторів використовуються лакмус, метило-вий оранжевий та фенолфталеїн.
Властивості деяких індикаторів наведено у таблиці:
| Індикатор | Інтервал рН переходу забарвлення | Забарвлення | |
| У кислому середовищі | У лужному середовищі | ||
| Метиловий фіолетовий | 0 – 3 | Жовто-зелене | Фіолетово-блакитне |
| Метиловий оранжевий | 3,1 – 4,4 | Червоне | Жовте |
| Лакмус | 5 – 8 | Червоне | Синє |
| Фенолфталеїн | 8,3 – 10 | Безбарвне | Червоне |
| Індигокармін | 12 – 14 | Блакитне | Жовте |
Більш точно визначають рН при допомозі спеціальних приладів – рН-метрів.
Звичайно індикатори – це слабкі органічні кислоти із узагальненою формулою HInd чи основи з IndOH, молекули та йони яких мають разно-манітне забарвлення. При додаванні у досліджуваний розчин індикатори дисоціюють:
| HInd ↔ H+ + Ind- | IndOH ↔ Ind+ + OH- |
| забарвлення 1 забарвлення 2 | забарвлення 1′ забарвлення 2′ |
Оскільки процес дисоціації слабких електролітів – процес оборот-ній, то положення рівноваги у наведених системах залежить від кислотно-сті досліджуваного розчину. У кислих розчинах індикатори, що являють собою слабкі кислоти, у відповідності до принципу Ле-Шателье знахо-дяться переважно у вигляді молекул і забарвлення розчину відповідає формі індикатора HInd (забарвлення 1). Індикатори, що є слабкими осно-вами, у кислих розчинах, навпаки, будуть знаходитись у своїй іонній формі Ind+ (забарвлення 2′). У процесі титрування змінюється концентра-ція катіонів водню та змінюється співвідношення йонів і молекул індика-тора. У певній області значень рН, названій областю переходу индикато-ра, концентрація однієї з форм стане переважною та розчин набуде її за-барвлення. Слабкими органічними кислотами є лакмус, фенолфталеїн. Слабка органичіна основа – метиловий оранжевий. Вибір індикатора ви-значається інтервалом рН, у якому необхідно підтримувати кислотність досліджуваного розчину.
ЙОННІ РЕАКЦІЇ
Реакції у розчинах електролітів, що перебігають між іонами, назива-ються йонними.
Йонні реакції завжди перебігають у бік зв’язування йонів, тобто у бік утворення важкорозчинних речовин, легколетких газів, слабких елек-тролітів, комплексних іонів. Якщо жодна з цих сполук не утворюється, то реакція перебігає оборотньо й не йде до кінця (правило Бертолле). Йонні реакції виражають сутність реакцій, що перебігають між електролітами у розчинах. Наприклад:
1. Реакції,що йдуть із утворенням осаду:
BaCI2(р) + Na2SO4(р) = BaSO4(к)↓ + 2NaCI(р).
Скорочене йонне рівняння виражає сутність цього процесу:
Ba2+(р) + SO42-(р) = BaSO4(к)↓.
2. Реакції, що сопровождуютьсяя виділенням газів (летких речовин):
2НCI(р) + Na2СO3(р) = Н2О(р) + СO2(г)↑ + 2NaCI(р)
або 2Н+(р) + СО32-(р) = Н2О(р) + СO2(г)↑.
3. Реакції, що перебігають із утворенням слабких електролітів:
2CH3COONa(р) + H2SO4(р) = 2CH3COOH(р) + Na2SO4(р)
або CH3COO-(р) + H+(р) = CH3COOH(р);
H2SO4(р) + 2КОН(р) = К2SO4(р) + 2Н2О(р)
або Н+(р) + ОН-(р) = Н2О.
4. Реакції, що йдуть із утворенням комплексного йону:
4KI(р) + Pb(NO3)2(р) = K2[PbI4](р) + 2KNO3(р)
або 4I-(р) + Pb2+(р) = [PbI4]2-(р).
ГІДРОЛІЗ СОЛЕЙ
Гідроліз у перекладі з грецької мови означає розклад водою. Гідро-лізові можуть поддаватися хімічні сполуки різноманітних класів: солі, галогенангідриди, естери, аміди, ацеталі, у тому числі й багато природних полімерів: поліцукриди, білки, нуклеїнові кислоти, тощо. У неорганічній хімії розглядають гідроліз солей, тобто обмінну взаємодію йонів солі з іонами води, яка супроводжується зміною концентрації йонів водню та гідроксилу. Необхідною умовою перебігу реакцій гідролізу є можливість утворення хоча б одного слабкого електроліту (кислоти чи основи). Тому гідролізові піддаються солі, утворені:
1. Сильними кислотами й слабкими основами, наприклад: CuSO4, Al(NO3)3, NH4CI, тощо (гідроліз за катіоном).
2. Слабкими кислотами та сильними основами, наприклад: Na2S, CH3COONa, K2CO3, Ba(CN)2 тощо (гідроліз за аніоном).
3. Слабкими кислотами та слабкими основами, наприклад: Al2S3, CH3COONН4, (NH4)2CO3, тощо (гідроліз за катіоном та аніоном).
Гідролізу не піддаются солі, утворенні сильними кислотами та сильними основами, оскільки ані катіон, ані аніон такої солі з іонами води не дає слабкого електроліту, наприклад: KCI, Na2SO4
Типові випадки гідролізу.
1. Гідроліз за катіоном:
NH4CI + НОН ↔ NH4ОН + НCl
(NH4CI ↔ NH4+ + CI-)
NH4+ + HOH ↔ NH4OH + H+.
Катіони солі взаємодіють із молекулами води. У розчині з’являється надлишок катіонів водню – середовище кисле, рН < 7.
Гідроліз солей багатозарядних катіонів перебігає постадійно, пере-важно за першою стадією, з утворенням основних солей:
2CuSO4 + 2HOH ↔ (CuOH)2SO4 + H2SO4
(CuSO4 ↔ Cu2+ + SO42-)
Cu2+ + HOH ↔ CuOH+ + H+.
Чим слабша основа, тим у більшій мірі піддається гідролізові, утво-рена нею сіль.
2. Гідроліз за аніоном:
CH3COONa + НОН ↔ CH3COOН + NaОН
(CH3COONa ↔ CH3COO- + Na+)
CH3COO- + НОН ↔ СН3СООН + ОН-
Аніон слабкої кислоти, відповідальний за гідроліз, взаємодіє з моле-кулами води. У розчині нагромаджуються аніони гідроксилу, середовище лужне, рН > 7.
Гідроліз солей багатооосновних кислот перебігає постадійно, пере-важно за першою стадією, з утворенням кислих солей.
Na2CO3 + HOH ↔ NaHCO3 + NaOH
(Na2CO3 ↔ 2Na+ + CO32-)
CO32- + HOH ↔ HCO3- + OH-.
Чим слабша кислота, тим у більшій мірі піддається гідролізові, утворена нею сіль.
3. Гідроліз за катіоном і за аніоном:
CH3COONН4 + НОН ↔ СН3СООН + NH4OH
(CH3COONН4 ↔ СН3СОО- + NH4+)
СН3СОО- + NH4+ + HOH ↔ СН3СООН + NH4OH
У залежності від співвідношення констант дисоціації, кислоти та ос-нови, що утворюються при гідролізі, розчини солей цього типу можуть мати нейтральну, слабкокислу чи слабколужну реакцію середовища.
Гідроліз деяких солей, утворених дуже слабкими кислотами та осно-вами, є необоротнім, наприклад гідроліз сульфідів і карбонатів Al3+, Cr3+, Fe3+: Al2S3 + 6HOH = 2Al(OH)3↓ + 3H2S↑.
У підсумку гідролізу утворюються осад і газ, тому гідроліз перебігає практично необоротно, до кінця.
Ступінь і константа гідролізу.
Кількісно процес гідролізу характеризується константою гідролізу (Кг) та стуепенем гідролізу (αг). Ступінь гідролізу показує яка часина мо-лекул розиненої солі поддається гідролізу. Вона може набувати значень від 0 до 1. Це відношення числа молекул, які поддались гідролізу, до за-гального числа молекул солі у розчині.
Ступінь гідролізу залежть від природи солі (природи катіону та аніо-ну), температури, концентрації. У відповідності з принципом Ле-Шательє зі зменшенням концентрації солі, тобто з розведенням ступінь гідролізу збільшується. Процес гідролізу – це ендотермічний процес, тому у відпо-відності з принципом Ле-Шательє з підвыщенням температури гідроліз підсилюється.
Отже для послаблення гідролізу треба готувати концентровані роз-чини та зберігати їх при низькій температурі, додавати у розчин солі один із продуктів гідролізу.
Константа гідролізу характеризує здатність даної солі піддаватися гідролізу. Чим слабкіше кислота (основа), сіль якої піддається гідролізові, тим більше Кг, тим у більшій мірі перебігає гідроліз. Наприклад:
KCN + HOH ↔ KOH + HCN
Кг = 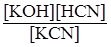 .
.
Тема 8. КОМПЛЕКСНІ СПОЛУКИ
Комплексними або координаційними називаються сполуки, у вузлах кристалічної решітки яких знаходяться агрегати йонів і молекул, здатні до самостійного існування у розчині.
Наукову теорію, яка пояснює будову та властивості координаційних сполук було сформульовано у 1883 році швейцарським хіміком А. Верне-ром. Згідно із координаційною теорією А.Вернера у молекулі будь-якої комплексної сполуки один з атомів або йонів, найчастіше позитивно заря-джений, займає центральне місце й називається комплексоутворювачем або центральним атомом (чи йоном). Молекули чи йони, розміщені нав-коло центрального атома називаються лігандами або адендами. Вони складають внутрішню (координаційну) сферу. А йони, що не розмістили-ся у координаційній сфері та знаходяться на дальшій відстані від ком-плексоутворювача, утворюють зовнішню сферу комплексної сполуки. Ємність або дентатність ліганду визначається числом місць, які він за-ймає у внутрішній (координаційній) сфері комплексу. Розрізняють моно-дентатні ліганди (F-, Cl-, Br-, I-, CN-, SCN-, N3-, NO2- H2O, NO, CO, тощо), бідентатні (CO32-, C2O42-, SO42-, SO32-, α-амінокислоти, тощо) та поліден-татні, існують ліганди зі змінною ємністю (наприклад S2O32- може бути як бідентатним так і монодентатним). Полідентатні ліганди, які утворюють кимплекси з центральним атомом стехіометрично моль на моль (незале-жно від заряду комплексоутворювача) називаються комплексонами. Чис-ло, яке показує скільки координаційних зв’язків утворили ліганди навко-ло комплексоутворювача називається координаційним числом (к.ч.). Межі внутрішньої сфери комплексу позначають квадратними дужками. Якщо внутрішня сфера комплексу у значній мірі зберігає стабільність при розчиненні, то йони, які перебувають у зовнішній сфері комплексу легко відщеплюються. Наприклад:
K2[PtCl6] ↔ 2K+ + [PtCl6]2-
Зовн. Внутр. Йонний
сфера сфера зв’язок
Координаційна теорія Вернера є наріжною у хімії комплексних спо-лук і донині. У розвитку хімії комплексних сполук значну роль відіграли праці російських, радянських і українських вчених: Чугуєва, Черняєва, Бабка, Голуба, Скопенка та інших.
Комплексоутворювачами можуть бути атоми або катіони металів, найчастіше d- та f-елементів. Іноді у ролі комплексоутворювачів можуть виступати і неметали: В3+, Si4+, N3-. Лігандами можуть бути негативно за-ряджені йони кислотних залишків та гідроксилів, нейтральні неорганічні молекули (H2O, NO, CO, NH3, тощо), молекули та радикали багатьох ор-ганічних речовин.
Координаційні числа центральних атомів можуть змінюатися у різ-них комплексних сполуках від 2 до 10. Найчастіше трапляються сполуки із координаційними числами 2, 4 та 6. Оскільки однакові координаційні числа мають різні за своєю природою та електронною будовою комплек-соутворювачі, то координаційні числа мають ще й просторову інтерпрета-цію, наприклад, координаційне число 4 може відповідати тетраедричній та квадратній координації лігандів.
А.Вернер прийшов дов висновку, що заряд центрального атома є ос-новним чинником, що впливає на координаційне число. Дуже часто коор-динаційне число дорівнює подвоєному ступеневі окислення комплексоут-ворювача. Однак, із цього правила існує чимало винятків. Окрім того, один і той же комплексоутворювача може мати декілька координаційних чисел, наприклад Al3+ має координаційні числа 6 і 4. Тобто координаційне число, окрім заряду комплексоутворювача, ще залежить від його елект-ронної будови, радіуса, а також від умов утворення комплексної сполуки.
Ступінь окислення комплексоутворювача розраховують, виходячи з того, що молекула (чи формульна одиниця) вцілому є електронейтраль-ною, тобто сума зарядів усіх частинок, що входять до складу формульної одиниці, дорівнює нулю. Наприклад:
K3[Fe(CN)6] ↔ 3K+ + [Fe(CN)6]3-;
Заряд (ступінь окислення) к.у. – х; 3 · 1 + х + 6 · (–1) = 0; х = 3.
[Cd(NH3)4]SO4 ↔ [Cd(NH3)4]2+ + SO42-;
Заряд (ступінь окислення) к.у. – х; х + 4 · 0 + (–2) = 0; х = 3.
Заряд комплексного йону дорівнює зарядові йонів зовнішньої сфери з протилежним знаком: K3[Со(NО2)6] ↔ 3K+ + [Со(NО2)6]3-;
Класифікація комплексних сполук.
І. За характером заряду комплекного йону.
Внутрішня сфера комплексу може бути катіоном, аніоном і не мати заряду, таким чином комплекси поділяються на три типи: катіонні, аніон-ні та нейтральні.
1) Катіонні комплекси утворюються за рахунок координації навколо позитивно зарядженого комплексоутворювача переважно нейтральних полярних молекул: [Zn(NH3)4]SO4 ↔ [Zn(NH3)4]2+ + SO42-;
2) Аніонні комплекси утворюються за рахунок координації навколо позитивно зарядженого комплексоутворювача переважно аніонів:
Na3[Со(NО2)6] ↔ 3Na+ + [Со(NО2)6]3-;
3) Нейтральні комплекси утворюються тоді коли сумарний заряд лі-гандів дорівнює зарядові комплексоутворювача. До нейтральних комп-лексів належать і сполуки з нульовим зарядом комплексоутворювача, це – карбоніли металів, наприклад [Fe(CO)5] – пентакарбонілзалізо.
ІІ. Залежно від природи лігандів комплексні сполуки поділяються на:
1) Аміакати (аміно-комплекси) – комплекси, у яких лігандами є молекули аміаку.
2) Гідрати або аква-комплекси – лігандами є молекули води.
3) Гідроксо- та ацидо-комплекси – лігандами виступають аніони гід-рокcилу (напр. Na3[Сr(ОH)6]) чи кислотних залишків (наприклад 4KCN · ·Fe(CN)2 → K4[Fe(CN)6]); до ацидо-комплексів належать також комплекс-ні кислоти (наприклад H[AuCl4], H2[SiF6]).
4) Змішані комплекси: [Cr(NH3)4(H2O)Cl]Cl2, K[PtCl3(NH3)3].
5) Циклічні або халатні комплекси – комплекси, що містять поліден-татні ліганди, які ніби охоплюють атом комплексоутворювача як якийсь предмет клешня рака. Найпростішими халатними комплесами можна вва-жати оксалатні комплекси перехідних металів: наприклад триоксалатофе-рати (ІІІ) лужних металів.
 |
Більш складним прикладом халат є нейтральні внутрішньокомплек-сні сполуки, зокрема з α-амінокислотами, які містять як звичайні ковален-тні так і донорно-акцепторні зв’язки. Прикладом може бути гліцинат міді, який має яскраво-синій колір:
 Н2С – NH2 O – C = O
Н2С – NH2 O – C = O




 | Cu |
| Cu |
O = C – O H2N – CH2
|
|
Дата добавления: 2013-12-13; Просмотров: 547; Нарушение авторских прав?; Мы поможем в написании вашей работы!