
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы электролитов
Классификация комплексных соединений
1. по характеру заряда иона – к.с. делятся на
- катионные – диссоциируют с образованием комплексного катиона
[Zn(NH3)4]Cl2 = [Zn(NH3)4]+2 + 2Cl‾
- анионные - диссоциируют с образованием комплексного аниона
K2[HgI4] = 2K+ + [HgI4]‾2
- нейтральные - не диссоциируют, т.е. это не электролиты, их молекулы состоят только из внутренней сферы
[Ni(CO)4] [Pt(NH3)2Cl2]
2. по природе лигандов различают
- аквакомплексы – лигандами является вода
[Cr(H2O)6]Cl2 [Al(H2O)6]Cl3
- аммиакаты – лигандами является аммиак
[Cu(NH3)4SO4]
- ацидокомплексы – лиганды кислотные остатки (комплексы типа двойных солей)
K2[PtCl4] Na3[Co(NO2)6]
- хелатные комплексы – комплексы металлов с полидентатными лигандами.
Такие комплексы образуют аминокислоты – при качественной реакции на аминокислоты (это реакции образования к.с.)

Наиболее эффективным хелатообразующим лигандом является этилендиаминтетрауксусная кислота (ЭДТА)

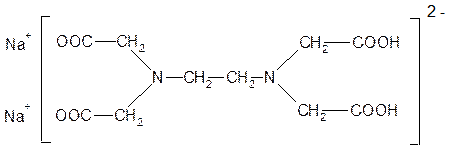
Трилон Б (Na2H2L)
Трилон Б образует устойчивые комплексы с катионами всех Ме, кроме щелочных, поэтому используется в аналитической химии для определения содержания катионов магния или кальция, для умягчения воды
Na2[H2L] + MgSO4→ H2[MgL] + Na2 SO4
[H2L]‾2 + Mg+2→ 2 H+ + [MgL]‾2
ЭДТА используется в медицине для выведения из организма ионов тяжелых Ме, однако это вещество вызывает декальцинацию организма, поэтому вместо ЭДТА применяют тетацин – кальций Na2[CaL].
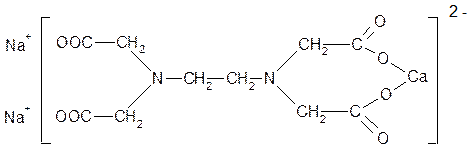
Тетацин – кальций Na2[CaL]
Na2[CaL] → 2 Na + + [CaL]‾2
[CaL]‾2 + Pb+2 → Ca2+ + [PbL]‾2
Важнейшие процессы жизнедеятельности протекают с участием комплексных соединений (к.с.). В живых организмах присутствуют к.с. многих жизненно важных металлов с белками, витаминами, веществами выполняющими важные функцию в обмене веществ. Многие природные к.с. содержат в качестве хелатных лигандов – порфириновые производные. В них 4 атома азота образуют 4 связи с комплексообразователем. В зависимости от природы комплексообразователя изменяются биологические функции комплекса. Комплекс порфирина с железом является основой гемоглобина и цитохромов, с кобальтом - витамин В12, с магнием – хлорофилл, с двумя Ме (железом и медью) – цитохромоксидаза.
Рассмотрим особенности строения гемоглобина. Комплексообразователь – железо представляет 6 свободных атомных орбиталей и образует 6 связей. 4 из них образует с порфириновым лигандом, одна – связь с белком – глобином, одна – занята водой. За счет замещения молекулы воды на молекулу кислорода гемоглобин переносит кислород. Схематичное изображение молекулы гемоглобина:
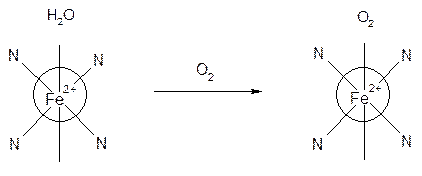
Глобин Глобин
При вдыхании воздуха содержащего угарный газ, в гемоглобине вода замещается на СО образуя очень стойкое соединение, поэтому кислородная емкость крови уменьшается. При легких отравлениях наблюдается головная боль, слабость, тошнота. При средних – нарушается координация движения, затмение сознания. При тяжелых – потеря сознания, судороги. Смерть наступает от остановки дыхания. Пострадавшим необходимы сердечные средства и чистый кислород.
Под действием окислителей – нитратов и нитритов – железо окисляется до + 3 и не способно переносить кислород, чтобы восстановить железо необходимы восстановители.
Таким образом, велика роль к.с. в биологических процессах и к.с. находят широкое практическое применение в химии и медицине.
ЛЕКЦИЯ № 6
 Все биологические системы (цитоплазма, кровь, лимфа, слюна, моча) являются водными растворами солей, белков, углеводов, липидов. Усвоение пищи, транспорт метаболитов, биологические реакции протекают в растворах. Биологические жидкости и отдельные компоненты клетки – это различные типы растворов. В медицине большинство лекарственных препаратов вводятся в виде растворов.
Все биологические системы (цитоплазма, кровь, лимфа, слюна, моча) являются водными растворами солей, белков, углеводов, липидов. Усвоение пищи, транспорт метаболитов, биологические реакции протекают в растворах. Биологические жидкости и отдельные компоненты клетки – это различные типы растворов. В медицине большинство лекарственных препаратов вводятся в виде растворов.
|
Дата добавления: 2013-12-13; Просмотров: 571; Нарушение авторских прав?; Мы поможем в написании вашей работы!